氢原子光谱(物理学内代名词)
温馨提示:这篇文章已超过424天没有更新,请注意相关的内容是否还可用!

氢原子光谱
物理学内代名词
氢原子光谱(Hydrogen spectral series)指的是氢原子内的电子在不同能阶跃迁时所发射或吸收不同波长、能量之光子而得到的光谱。
| 中文名 | 氢原子光谱 |
| 英文名 | Hydrogen spectral series |
| 发现者 | 约翰·雅各布·巴尔末 |
| 特征 | 氢原子光谱为不连续的线光谱 |
简介
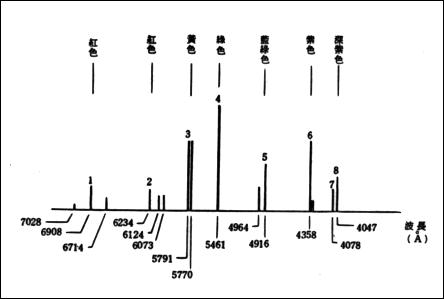
最简单的原子光谱,由A.J.埃斯特朗首先从氢放电管中获得,后来W.哈根斯和H.C.沃格耳等人在拍摄恒星光谱中也发现了氢原子光谱线。到1885年,人们已在可见光和近紫外光谱区发现了氢原子光谱的14条谱线,谱线强度和间隔都沿着短波方向递减。其中可见光区有4条,分别用
 氢原子光谱
氢原子光谱表示。其波长的粗略值分别为6562.8┱、4861.3┱、4340.5┱和4101.7┱。1885年,瑞士物理学家J.J.巴耳末首先把上述光谱用经验公式:
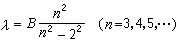 氢原子光谱
氢原子光谱表示出来,式中B为一常数。这组谱线称为巴耳末线系。当n→∞时,λ→B,为这个线系的极限,这时邻近二谱线的波长之差趋于零。下图是巴耳末线系的示意图。1890年J.R.里德伯把巴耳末公式简化
式中,称为里德伯常数,其值为(1.096775854±0.000000083)×10%m。后来又相继发现了氢原子的其他谱线系,都可以用类似的公式表示。把波长的倒数称波数,单位是m,则氢原子光谱的各谱线系的波数都可用一个普遍公式表示:
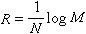 氢原子光谱
氢原子光谱对于一个已知线系,m为一定值,而n为比m大的一系列整数。此式称为广义巴耳末公式。氢原子光谱现已命名的6个线系如下:
赖曼系m=1,n=2,3,4,...紫外区
巴耳末系m=2,n=3,4,5,...可见光区
帕邢系m=3,n=4,5,6,...红外区
布喇开系m=4,n=5,6,7,...近红外区
芬德系m=5,n=6,7,8,...远红外区
汉弗莱系m=6,n=7,8,9,...远红外区
在广义巴耳末公式中,若为光谱项,则该式可写成氢原子任一光谱线的波数可表示为两光谱项之差的规律称为并合原则,或称里兹组合原则。
对于核外只有一个电子的类氢离子(如He,Li等)广义巴耳末公式仍适用,只是核的电量和质量与氢原子核不同,要对里德伯常数R作相应的变动。
当用分辨本领很高的分光仪器去观察氢原子的各条光谱线时,发现它们又由若干相近的谱线组成,这称为氢原子光谱线的精细结构。它来源于氢原子能级的细致分裂。分裂的主要原因是①相对论效应所引起的附加能量ΔEr;②电子自旋和轨道相互作用所引起的附加能量ΔEιε。同时考虑以上两个因素后,算得氢原子的能级公式为
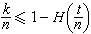 氢原子光谱
氢原子光谱式中h为普朗克常数
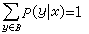 氢原子光谱
氢原子光谱1947年W.E.兰姆和R.C.雷瑟福用分子束磁共振法研究氢原子能级的精细结构时测得2S½比2P½高出0.033cm,现在称之为兰姆移位,它很快由量子电动力学得到了解释。
光电效应
(1)定义:在光的照射下从金属表面发射出电子的现象(发射出的电子称为光电子)。
(2)产生条件:入射光的频率大于金属极限频率。
(3)光电效应规律:①存在着饱和电流:对于一定颜色的光,入射光越强,单位时间内发射的光电子数越多。②存在着遏止电压
参考资料
1.有关“氢原子光谱”的内容·快读网





