铱(金属元素)
铱
金属元素
铱:原子序数77,原子量192.22,科学家用王水溶解粗铂时,从残留在器皿底部的黑色粉末中发现了两种新元素—锇和铱。铱在地壳中的含量为千万分之一,常与铂系元素一起分散于冲积矿床和砂积矿床的各种矿石中。自然界存在两种同位素:铱191、铱193。
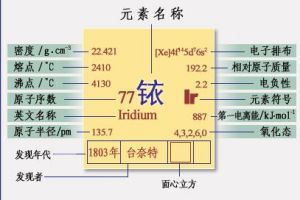
| 中文名 | 铱 |
| 符号 | Ir |
| 序号 | 77 |
| CAS号 | 7439-88-5 |
| 族 | 9 |
| 周期 | 6 |
| 元素分区 | d |
| 原子质量 | 192.217g·mol−1 |
| 密度 | 22.56g·cm−3 |
| 外观 | 银白色 |
| 熔点 | 2739 K,2466 °C, 4471 °F℃ |
| 沸点 | 4701 K,4428 °C, 8002 °F℃ |
化学符号
属于周期表Ⅷ族过渡元素,原子序数77,原子量192.2,面心立方晶格,是一种稀有的贵金属材料。
简史1803年英国坦南特(s.Tennant)由分离铂后的黑色残渣中发现铱;1813年进行了铱的第一次熔化实验;1860年帝俄造币厂用约8kg原生含铱材料和其他残渣作原料进行熔炼,得到一个1.805kg重的铱锭。1881年霍兰(J.Holland)以“熔化和铸造铱的工艺”为题申请了美国专利。此后,各国的冶金工作者们为解决铱的加工问题作了大量工作。
性能:铱的主要性能是:⑴密度22.42g/cm^3;⑵熔点2454℃,铱制品使用温度可达210[4]0~2200¨C;⑶弹性模量高(538.3GPa),泊松系数低(0.26),低温塑性很差;⑷是最耐腐蚀的金属,致密态铱不溶于所有无机酸,也不被其他金属熔体浸蚀,例如熔化的铅、锌、镍、铁、金等;能耐许多熔融试剂和高温硅酸盐的浸蚀;⑸像其他铂族金属合金一样,铱合金能牢固吸附有机物,可作催化剂材料;⑹铱在空气或氧气中600℃以上生成IrO2,并在1100℃分解;在1227℃空气中铱的挥发量为铂的100倍。铱可采用高频或中频炉、电弧炉、电子束炉等熔炼。铱在1600℃以上具有好的塑性,通常进行热加工。
用途:铱的高熔点、高稳定性使其在很多特殊场合具有重要用途,但铱的脆性和高温损耗在一定程度上限制了它的应用。铱的最早应用是作笔尖材料,后来又提出了注射针头、天平刀刃、罗盘支架、电触头等方面的用途。铱坩埚可用于生长难熔氧化物晶体,该坩埚能在2100~2200℃工作几千小时,是重要的贵金属器皿材料。铱的高温抗氧化性和热电性能使铱/铱铑热电偶成为惟一能在大气中测量达2100℃高温的贵金属测温材料;可用作放射性热源的容器材料;阳极氧化铱膜是一种有前途的电显色材料。Ir192是γ射线源,可用于无损探伤和放射化学治疗。同时,铱是一个很重要的合金化元素,一些铱合金使用在某些关键部门;铱化合物亦有其特有用途。
发现历史
1803年,英国化学家坦南特和法国化学家德斯科蒂等人研究了铂系矿石溶于王水后的渣子。他们宣布残渣中有两种不同于铂的新金属存在,它们不溶于王水。
1804年,泰纳尔发现并命名了它们。其中一个命名为irdium(铱),元素符号定为Ir。这一词来自希腊文iris,原意是“彩虹”。这可能是由于二氧化铱的水合物IrO2 ·2H2O或Ir(OH)4,从溶液中析出沉淀时,颜色或青、或紫、或深蓝、或黑,随着沉淀的情况而改变。
性质
物理性质
 铱
铱性状:银白色的铂族过渡金属。
第一电离能:9.1电子伏特。
莫氏硬度:6.5,硬度高且脆,高温时可压成薄片或拉丝。
密度:22.42 g/cm 是密度第二高个的元素(次于锇)。
强度:耐2000℃的高温。质地坚硬,难以加工,通常与铂溶成合金用于耐磨、耐高温、耐腐蚀的器件上;
金属互化物:为超导体。
晶体结构:晶胞为面心立方晶胞,每个晶胞含有4个金属原子。
化学性质
耐腐蚀性:铱是已知最耐腐蚀的金属,只有铱粉可缓慢溶于王水,稍受熔融的强碱侵蚀,某些盐类和卤素对固体铱有腐蚀性。
反应:铱在强热时可与氧、氟、氯反应;
催化性:铱有形成配位化合物的强烈倾向和良好的催化性能。
活性:当铱被磨成粉末将更具化学活性且易燃。
主要化合价:+2、+4、+6
化合物
氧化态
-3 [Ir(CO)3]
-1 [Ir(CO)3(PPh3)]
0 Ir4(CO)12
+1 [Ir(CO)Cl(PPh3)2]
+2 IrCl2
+3 IrCl3
+4 IrO2
+5 Ir4F20
+6 IrF6
铱化合物的氧化态介乎−3和+6,最常见的有+3和+4。高氧化态的化合物比较罕见,包括IrF6和两种混合氧化物Sr2MgIrO6及Sr2CaIrO6。2009年,科学家利用基质隔离方法(在6 K的氩气中)对过氧化铱配合物进行紫外线照射,制成了四氧化铱(IrO4)。然而这一化合物预计在更高的温度下无法稳定保持固体状态。[5] 参见分类:铱化合物
二氧化铱(IrO2)为棕色粉末,是铱唯一一种性质已经过充分研究的氧化物。三氧化二铱是一种黑蓝色粉末,在硝酸中会氧化成IrO2。其他已知的化合物包括二硫化铱、二硒化铱、三硫化二铱和三硒化二铱等,另外也有研究指出IrS3的存在。铱还可以形成氧化态为+4和+5的铱酸,如K2IrO3和KIrO3。在高温下使铱与氧化钾或超氧化钾反应,就可取得这些铱酸。
目前尚未发现化学式为IrxHy的氢铱二元化合物,但有些已知配合物包含IrH4−
5和IrH3−
6离子,其中铱的氧化态分别为+1和+3。科学家认为,Mg6Ir2H11当中同时存在IrH4−
5以及含18个电子的IrH5−
4离子。
铱并不形成一卤化物和二卤化物,而是会与每一种卤素形成对应的三卤化物IrX3。氧化态为+4或以上的卤化物只有四氟化铱、五氟化铱和六氟化铱。六氟化铱(IrF6)是一种反应性很高的挥发性黄色固体,其分子结构呈八面体形。它在水中会分解,而且铱黑(即金属铱粉末)可将其还原成晶体状的四氟化铱(IrF4)。五氟化铱的特性相似,但它其实是一种四聚体Ir4F20,由四个角对角连接的八面体所形成。
工业上最重要的铱化合物是六氯铱酸(H2IrCl6)及其铵盐。铱的纯化过程、大多数铱化合物的生产初始步骤以及阳极涂层的制备过程都要用到这些化合物。IrCl2−
6离子呈棕黑色,能够轻易还原成浅色的IrCl3−
6,且该反应可以逆转。三氯化铱(IrCl3)常被用作其他Ir(III)化合物的制备原料。氯和铱粉末在650 °C经氧化反应会形成无水三氯化铱,而Ir2O3溶于氢氯酸中则可制成水合三氯化铱。另一种类似的制备原料是六氯铱酸铵((NH4)3IrCl6)。三价铱配合物具抗磁性,分子结构一般为八面体型。
铱的有机化合物含有铱﹣碳键,其中铱的氧化态通常较低。比如,十二羰基四铱(Ir4(CO)12)是最常见兼最稳定的金属羰基配合物,当中的铱就处于0氧化态。十二羰基四铱中的每一个铱原子都与另外三个键合,形成四面体原子簇。一些重要的Ir(I)有机化合物都是以发现者命名的。这包括沃什卡配合物(IrCl(CO)[P(C6H5)3]2),它会与O2氧分子键合,这种特性十分特殊。克拉布特利催化剂(Crabtree's catalyst)是一种用于氢化反应的均相催化剂。这些化合物都属于平面正方形d配合物,共有16个价电子,因此反应性很高。
同位素
主条目:铱的同位素
铱有两种自然稳定同位素:Ir和Ir,丰度分别为37.3%和62.7%。已人工合成的放射性同位素共有34种,质量数从164至199不等。Ir夹在两个稳定同位素之间,也是最稳定的放射性同位素,半衰期为73.827天。这一同位素在近距离治疗和工业射线照相技术中具有用途,特别是在天然气工业中用于无损检测钢铁的焊接处。铱-192曾造成多宗辐射意外。另外有三个同位素的半衰期在一天以上:Ir、Ir和Ir。质量数低于191的同位素会同时进行β衰变、α衰变以及质子发射,但有两者除外:Ir进行电子捕获,而Ir进行正电子发射。质量数高于191的同位素则进行β衰变,其中Ir会少量进行电子捕获。所有铱同位素都是在1934至2001年间发现的,其中最新发现的是Ir。[5]
铱共有32种已知同核异构体,质量数介乎164到197。最稳定的同核异构体是Ir,它会经同核异能跃迁,半衰期为241年,因此比所有处于基态的放射性同位素都要稳定。最不稳定的异构体是Ir,其半衰期只有2微秒。Ir是所有元素中首个被证实呈现穆斯堡尔效应的同位素。该同位素应用在穆斯堡尔光谱分析中,在物理学、化学、生物化学、冶金学和矿物学等领域都有用到。
特点
铱属铂系元素。铂系元素几乎完全成单质状态存在,高度分散在各种矿石中,例如原铂矿、硫化镍铜矿、磁铁矿等。铂系元素几乎无例外地共同存在,形成天然合金。在含铂系元素矿石中,通常以铂为主要成分,而其余铂系元素则因含量较小,必须经过化学分析才能被发现。由于锇、铱、钯、铑和钌都与铂共同组成矿石,因此它们都是从铂矿提取铂后的残渣中发现的。
铂系元素化学性质稳定。它们中除铂和钯外,不但不溶于普通的酸,而且不溶于王水。铂很易溶于王水,钯还溶于热硝酸中。所有铂系元素都有强烈形成配位化合物的倾向。1803年,法国化学家科勒德士戈蒂等人研究了铂系矿石溶于王水后的渣子。他们宣布残渣中有两种不同于铂的新金属存在,它们不溶于王水。1804年,泰纳尔发现并命名了它们。其中一个命名为irdium(铱),元素符号定为Ir。这一词GD来自希腊文iris,原意是“虹”。这可能是由于二氧化铱的水合物IrO·2H传或Ir(OH)4,从溶液中析出沉淀时,颜色或青、或紫、或深蓝、或黑,GA随着沉淀的情况而改变。
种类
铱金:是稀有贵重金属,是铂和铱的合金,稀有程度在铂金之上。其熔点、强度和硬度都很高。颜色为银白色,具强金属光泽,硬度7。相对密度22.40,性脆但在高温下可压成箔片或拉成细丝,熔点高,达2454℃。化学性质非常稳定,不溶于王水。主要用于制造科学仪器、热电偶、电阻绫等。高硬度的铁铱和铱铂合金,常用来制造笔尖和铂金首饰。由于其极高的熔点和超强的抗腐蚀性,铱在高水平技术领域中得到广泛的使用,如航天技术,制药和汽车行业。
铱(Ir)
熔点(℃): 2454
强度(kgf/mm2) :112
电阻(μΩ·㎝): 5.3
硬度:240
铱丝:呈细丝状金属铱加工材料。铱丝的电阻系数为6.03×10-2Ωmm2/m, 抗拉强度1493MPa,伸长率10%~20%。用粉末冶金法和熔铸-压力加工法均可生产出Ф0.15mm细丝。铱丝用作高温抗氧化热电偶材料和灯丝材料。Ir-W热电偶E2200℃=44.19mv,在1000~2000℃范围内,热电势与温度的关系几乎成直线,但只能在中性气氛或真空中使用。
铱合金:以铱为基加入其他元素组成的合金。
常用的铱合金有Ir-40Rh、Ir-70Rh、Ir-20Ru、Ir-10Ru等合金。
其主要特点是热电性能良好、高温抗氧化、耐腐蚀。Ir-Ru系合金硬而脆难于加工。
铱合金主要用作高温抗氧化热电偶及电接触材料,用Ir-Rh做热电偶使用温度可高达2000℃以上。
铱铑合金:是铱和铑的二元合金,在高温下为连续固溶体,有IrRhl0、IrRh40、IrRh50和IrRh­70等合金。Ir-Rh40合金的铸态维氏硬度l736MPa,IrPh70的为1422MPa。合金的高温抗氧化能力比纯铱强,在2000℃时IrRh60氧化失重约5%。而纯铱失重高达27%。用高频炉氩气保护熔炼,铸锭经热轧和适量的冷加工成材。主要用作高温抗氧化热电偶,使用温度可达2000℃以上,有IrRh60-Ir、IrRh40-Ir以及IrRh50-IrRu10等,后者热电势最高,在2000℃时可达17.18mV。
资源
发现的铂族矿物和含铂族元素的矿物已超过80种,加上变种和未定名矿物已达200个。在自然界中,铂族金属主国呈自然元素、自然合金、锑化物、硫化物、硫砷化物和铋碲化物的单独矿物存在,部分呈类质同像存在于硫化物,如黄铜矿、镍黄铁矿、紫硫镍(铁)矿等中。
存量
铱是地球地壳中最稀有的元素之一,平均质量比例只有百万分之0.001。金的丰度是它的40倍,铂是它的10倍,而银和汞都是它的80倍。碲的丰度与铱相近,另外只有三种稳定元素比铱更加稀有:铼、钌和铑,其中后两者的丰度是铱的十分之一。相比之下,铱在陨石里的含量则高很多,一般在百万分之0.5以上。科学家相信,铱在整个地球的含量比在地壳中的含量高很多,但由于它密度高,而且具亲铁性,所以在地球仍处于熔融状态时,就已沉到地球的内核了。
铱在自然中以纯金属或合金的形态出现,尤其是各种比例的铱﹣锇合金。镍和铜矿藏中含有铂系金属的硫化物(如(Pt,Pd)S)、碲化物(如PtBiTe)、锑化物(PdSb)和砷化物(如PtAs2)。这些化合物中的铂会被少量的铱和锇元素取代。与其他铂系元素一样,铱可以形成自然镍合金及铜合金。
地壳中有三种地质结构的铱含量最高:火成岩、撞击坑以及前二者演化而成的地质结构。最大的已知矿藏有南非的布什维尔德火成杂岩体、俄罗斯的诺里尔斯克及加拿大的索德柏立盆地等。美国有较小的锇矿藏。铱也出现在次生矿藏中,与冲积层矿藏中的铂以及其他铂系元素结合。前哥伦布时期哥伦比亚乔科省居民所用的冲积层矿藏至今仍是铂系元素的一大来源。截至2003年,并没有数据记录全球铱储藏量。
白垩纪
主条目:白垩纪-第三纪灭绝事件
6600万年前形成的K-T界线记录了从白垩纪到古近纪的转折点,此地层的黏土的铱含量异常高。路易斯·阿尔瓦雷茨为首的研究团队在1980年提出假说,指这一地层中的铱是小行星或彗星撞击地球时带来的。这一理论称为阿尔瓦雷茨假说,目前被公认为恐龙灭绝的最佳解释。后来人们在中美洲尤卡坦半岛地底发现了约6600万年前形成的大型撞击坑,即希克苏鲁伯陨石坑,这很可能就是阿尔瓦雷茨假说中那颗陨石的撞击地点。杜威·麦克林(Dewey M. McLean)等人则认为是火山活动把铱带到地球表面的,因为地球深处存在更多的铱元素,而且许多火山至今仍在放出铱,如留尼汪岛上的富尔奈斯火山。
提取
从矿石中提取
 铱合金
铱合金砂铂矿或含铂族金属的砂金矿用重选法富集可得精矿,铂或锇、铱的含量能达70-90%,可直接精炼。50年代以来铂族金属主要从铜镍硫化物铱共生矿中提取,小部分从炼铜副产品中提取。铂族含量高的冰镍,现在氧压下硫酸浸出,或氯化冶金分离其他金属后获得铂族精矿。铂族精矿经过直接溶解、分离、提纯,或先将锇、钌氧化挥发他离后,再分离、提纯其他铂族金属。
用乙醇-盐酸溶液吸收
将吸收液再加热蒸馏,并用碱液吸收得锇酸钠。在吸收液中加氯化铵,则锇以铵盐形式沉淀,在氢气中煅烧,可得锇粉。在蒸出锇的残液中加氯化铵,可得钌的铵盐,再在氢气中煅烧,可得钌粉。浸出钌和锇后的残渣主要为氧化铱,用王水溶解,加氯化铵沉出粗氯铱酸铵,经精制,在氢气中煅烧,可得铱粉。将铂族金属粉末用粉末冶金法或通过高频感应电炉熔化可制得金属锭。
制取高纯铂族金属
一般将金属溶解后,经反复提纯,精制方法有载体氧化水解、离子交换、溶剂萃取和重复沉淀等,然后再以铵盐沉出,经煅烧可得相应的高纯金属。
相关产品
铱金
铱金是稀有贵重金属,是铂和铱的合金,稀有程度在铂金之上。其熔点、强度和硬度都很高。颜色为银白色,具强金属光泽,硬度7。相对密度22.40,性脆但在高温下可压成箔片或拉成细丝,熔点高,达2454℃。化学性质非常稳定,不溶于水。主要用于制造科学仪器、热电偶、电阻绫等。高硬度的铁铱和铱铂合金,常用来制造笔尖和铂金首饰。
铱丝
呈细丝状金属铱加工材料。铱丝的电阻系数为6.03×10-2Ωmm2/m,铱丝用作高温抗氧化热电偶材料和灯丝材料。
铱铑合金
铱和铑的二元合金,在高温下为连续固溶体,有IrRhl0、IrRh40、IrRh50和IrRh­;70等合金。Ir-Rh40合金的铸态维氏硬度l736MPa,IrPh70的为1422MPa。合金的高温抗氧化能力比纯铱强,在2000℃时IrRh60氧化失重约5%。而纯铱失重高达27%。用高频炉氩气保护熔炼,铸锭经热轧和适量的冷加工成材。主要用作高温抗氧化热电偶,使用温度可达2000℃以上,有IrRh60-Ir、IrRh40-Ir以及IrRh50-IrRu10等,后者热电势最高,在2000℃时可达17.18mV。
用途
 铱做的笔尖
铱做的笔尖最重要的铱化合物为其盐类和氯化的酸类 ,铱也可以形成有机金属化合物,作为工业用催化剂和研究用途,例如用于化学工业上合成醋酸的CativaTM 催化法需要使用铱的羰基配合物[Ir(CO)2I2]−。
铱目前使用于需要在高耐蚀性,高温工作环境的设备,如火星塞,坩埚(高温下的半导体再结晶)和生产氯气的氯碱法之电极。因其抗腐蚀性,铱也用于放射性同位素热电机的保护层 。
汽车工业界,铱可用于制作高档次火花塞的放电极,其性能优于铜质火花塞。
由于铱耐磨的特性,过去也大量用于钢笔之笔尖。于笔尖上附上一块耐磨之铂铱合金,称为铱点。现今仍保留铱点之称呼,但已很少含有铱 。
铱可在铂矿中发现。熔点、硬度都比铂高。铱铂合金曾被用于制作国际米原器,用10%铱和90%铂的合金制成国际米尺,作为长度单位米的标准。
安全
成块的铱金属没有生物用途亦无害,因为它不与生物组织反应。人体组织内的铱比例只有一兆(万亿)分之二十左右。和大部份金属一样,铱的金属细粉具有危险性。这样的粉末会刺激组织,且容易在空气中燃烧。由于铱化合物的处理量一般都很低,所以人们对其毒性所知甚少。不过铱的可溶盐,如各种卤化铱,则含有毒性。大部份铱化合物都不可溶,所以很难被人体吸收。
Ir同位素和其他放射性同位素一样是危险的。唯一的相关意外是在近距离治疗时受该同位素辐射的意外照射。Ir所放出的高能伽马射线会提高患癌症的可能性。外照射可导致烧伤、辐射中毒甚至死亡。摄入Ir可导致肠胃内膜烧伤。进入体内的Ir、Ir和Ir主要会积累在肝脏中,所放出的伽马射线和β辐射会对身体造成损害。
铱星系统
铱星(Iridium)系统简介:铱系统诞生于1998年,是由66颗低轨卫星组成的全球卫星移动通信系统。66颗低轨卫星分布在6个极地轨道上,另有6颗备份星。铱系统最初设计是77颗在轨卫星。其结构正好和金属元素铱的结构相同,因而得名铱系统。虽然后来设计中将铱系统整个星系卫星数量减少到66颗,但仍然保留了原来的铱系统的名称。星上采用先进的数据处理和交换技术,并通过星际链路在卫星间实现数据处理和交换、多波束天线。铱系统最显著的特点就是星际链路和极地轨道。星际链路从理论上保证了可以由一个关口站实现卫星通信接续的全部过程。极地轨道使得铱系统可以在南北两极提供畅通的通信服务。铱系统是唯一可以实现在两极通话的卫星通信系统。铱系统最大的优势是其良好的覆盖性能,可达到全球覆盖。可为地球上任何位置的用户提供带有密码安全特性的移动电话业务。低轨卫星系统的低时延给铱系统提供良好的通信质量。铱系统可提供电话、传真、数据、和寻呼等业务。它的用户终端有双模手机、单模手机、固定站、车载设备和寻呼机。
阿尔瓦兹假说
在K-T界线粘土层有不寻常高丰度的铱,引起了阿尔瓦兹假说,该假说解释在6500万年前一个巨大的陨石撞击地壳,所造成恐龙以及许多其他物种的灭绝,因为铱在陨石中的丰度远高于地球的地壳平均丰度。一般认为铱在地球上的总量应高于在地壳岩石的观察,当地球刚诞生,还是熔融状态时,因铱与其他铂类金属的高密度和让他们有和铁键结的趋势,造成大量的铱下沉到地壳以下和铁结合。
参考资料
1.世界五大最贵的金属 最贵的1克4亿,也是癌症的“克星”·腾讯网
2.LDH双铱金超级火花塞亮相北京汽用展·58汽车