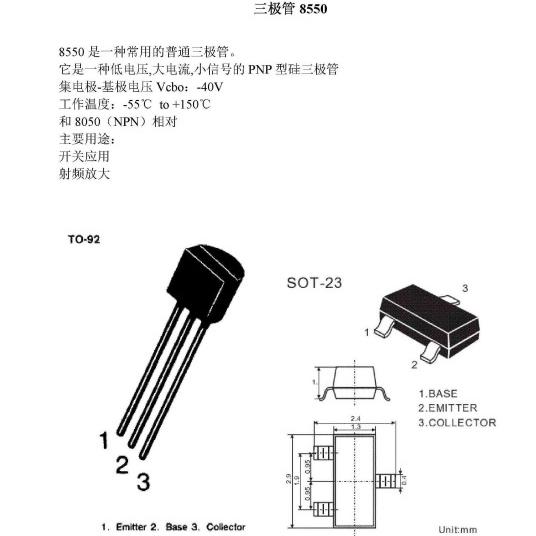
氯化银(白色粉末状物质)

氯化银
白色粉末状物质
氯化银是银的氯化物,由可溶的银化合物如硝酸银与氯离子反应获得。氯化银在电化学中非常重要的应用是银-氯化银-参比电极。氯化银是照相感光乳剂的组分,感光能力次于溴化银,高于碘化银。避光保存,宜用黑纸包装。用作防腐剂及神经镇静剂。也用于镀银、医药、制造宇宙线电离检测器等,单晶可作红外吸收槽和透镜元件。
| 化学式 | AgCl |
| 熔点 | 455 |
| 沸点 | 1550 |
| 密度 | 5.56克/厘米3 |
| 外观 | 白色粉末 |
| 名称 | 氯化银 |
| 英文名 | Silver chloride |
| IUPAC名 | Silver chloride |
| 溶解度(水) | 不溶 |
化学性质
见光易分解,开始变灰,最后变黑。溶于氨水、硫代硫酸钠或氰化钾溶液,分别形成稳定的配离子(见配位化合物)。
和金属反应
2AgCl+Zn=ZnCl2+2Ag
AgCl悬浊液中还是有银离子的,所以锌(Zn)可以与银离子反应,置换出银,所以AgCl悬浊液能和Zn反应。
生成硫化银的反应
2AgCl+Na2S=Ag2S+2NaCl
硫化银的溶解度比氯化银还小,根据沉淀转化的原理,氯化银可以和硫离子反应生成硫化银。
在氨溶液中的溶解
AgCl+ 2NH3 -→ [H3N-Ag-NH3] + Cl
与其它卤化银盐如AgBr和AgI不同的是氯化银能够溶解在稀的氨溶液中,在氰酸溶液中氯化银也能溶解并形成类似的复合物。在浓盐酸中氯化银可以形成[Cl-Ag-Cl]-,因此有限可溶。
在氨溶液中加入硫化物又可以形成不可溶的银盐:
2[Ag(NH3)2] + S ==Ag2S + 4 NH3
制备方法
由于硝酸银溶于水中,在不断搅拌下,加入纯盐酸,生成白色氯化银沉淀,立即过滤,吸干,用水反复洗涤至无硝酸根为止,70℃烘干制得。全部合成工作均应在暗室进行,以免产品遇光分解。产品应储存在棕色玻璃瓶中。
NaCl+AgNO3=AgCl↓+NaNO3
HCl+AgNO3=AgCl↓+HNO3
主要用途
照相
在不是非常敏感的照片软片、胶版和胶纸上有使用氯化银。但一般软片上使用的是化学性质上类似,但是更加对光敏感的溴化银AgBr。
电极
在大自然中氯化银以角银矿的形式出现。由于氯化银非常不易溶,因此在实验室中它常被用来测定样品的含银量。
氯化银可用于制造电池,以及光学和药学等方面。
氯化银在电化学中非常重要的应用是银-氯化银-参比电极。这种电极不会被极性化,因此可以提供精确的数据。
由于实验室中越来越少使用汞,因此Ag/AgCl-电极的应用越来越多。用氯化银提取金属单质银。
这种电极可以使用电化学氧化的方式在盐酸中制作:比如将两根银线插入盐酸中,然后在两根线之间施加一至二伏电压,阳极就会被氯化银覆盖(阳极反应:2 Ag + 2 HCl→2 AgCl + 2 H ++ 2 e-,阴极反应:2 H + 2e-→H2,总反应:2 Ag + 2 HCl → 2AgCl + H2)。使用这个方式可以确保氯化银只在电极有电的情况下产生。
急救措施
皮肤接触:流动水洗净即可。
眼睛接触:用流动水清洗即可。
法规信息
中华人民共和国安全生产法;
中华人民共和国职业病防治法;
中华人民共和国环境保护法;
危险化学品安全管理条例;
参考资料
1.氯化银·Chemical Book
2.氯化银安全技术说明书·SOMSDS