氧族元素(元素周期表上ⅥA族元素)
温馨提示:这篇文章已超过376天没有更新,请注意相关的内容是否还可用!
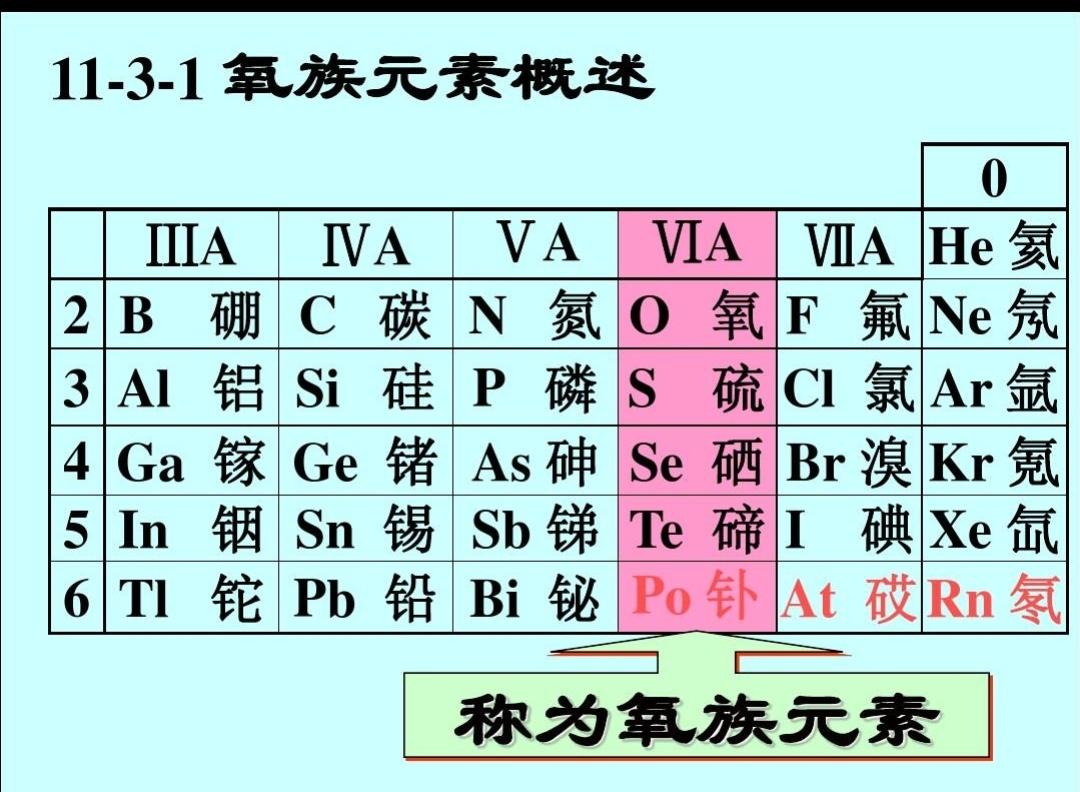
氧族元素
元素周期表上ⅥA族元素
氧族元素是位于元素周期表上ⅥA族元素,包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、鉝(Lv)六种元素,其中钋、鉝为金属,碲为准金属,氧、硫、是典型的非金属元素。其熔点沸点依次递增,除钋外都是分子晶体,所以熔沸点随相对分子质量增大而增高。
| 中文名 | 氧族元素 |
| 英文名 | Chalcogen |
| 位置 | ⅥA族元素 |
| 包括 | 氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、Uuh |
定义
是元素周期表上的ⅥA族元素(IUPAC新规定:16族)。这一族包含氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)、116号元素(Uuh)六种元素,其中钋为金属,碲为类金属,氧、硫、硒是典型的非金属元素。在标准状况下,除氧单质为气体外,其他元素的单质均为固体。在和金属元素化合时,氧、硫、硒、碲四种元素通常显-2氧化态;但当硫、硒、碲处于它们的酸根中时,最高氧化态可达+6。一些过渡金属常以硫化物矿的形式存在于地壳中,如FeS2、ZnS等。
原子结构
相同点
原子最外层有6个电子
反应中易得到2个电子
表现氧化性
不同点
除氧外其它氧族元素d轨道可参与成健,形成配位数为6的络合物
核电荷数依次增大
电子层数依次增大
原子半径依次增大,得电子能力依次减弱,氧化性依次减弱.
单质
氧
氧气通常条件下是呈无色、无臭和无味的气体,密度1.429克/升,1.419克/立方厘米(液),1.426克/立方厘米(固),熔点-218.4℃,沸点-182.962℃,在-182.962℃时液化成淡蓝色液体,在-218.4℃时凝固成雪状淡蓝色。固体在化合价一般为0和-2。电离能为13.618电子伏特。
除惰性气体外的所有化学元素都能同氧形成化合物。大多数元素在含氧的气氛中加热时可生成氧化物。有许多元素可形成一种以上的氧化物。氧分子在低温下可形成水合晶体O₂.H₂O和O₂.H₂O₂,后者较不稳定。氧气在空气中的溶解度是:4.89毫升/100毫升水(0℃),是水中生命体的基础。氧在地壳中丰度占第一位。干燥空气中含有20.946%体积的氧;水有88.81%重量的氧组成。除了O16外,还有O17和O18同位素。
硫
单质物理性质:
通常为淡黄色晶体,它的元素名来源于拉丁文,原意是鲜黄色。单质硫有几种同素异形体,菱形硫(斜方硫)和单斜硫是现在已知最重要的晶状硫。它们都是由S8环状分子组成。
密度熔点沸点存在条件
菱形硫(S8)2.07克/立方厘米112.8℃444.674℃200℃以下
单斜硫(S8)1.96克/厘米3119.0℃444.6℃200℃以上
硫单质导热性和导电性都差。性松脆,不溶于水,易溶于二硫化碳(弹性硫只能部分溶解)。无定形硫主要有弹性硫,是由熔态硫迅速倾倒在冰水中所得。不稳定,可转变为晶状硫(正交硫),正交硫是室温下唯一稳定的硫的存在形式。
化学性质:
化合价为-2、+2、+4和+6。第一电离能10.360电子伏特。化学性质比较活泼,能与氧、金属、氢气、卤素(除碘外)及已知的大多数元素化合。还可以与强氧化性的酸、盐、氧化物,浓的强碱溶液反应。它存在正氧化态,也存在负氧化态,可形成离子化合物、共价化合成物和配位共价化合物。
硒
稀散元素之一。在已知的六种固体同素异形体中,三种晶体(α单斜体、β单斜体,和灰色三角晶)是最重要的。也以三种非晶态固体形式存在;红色和黑色的两种无定形玻璃状的硒。前者性脆,密度4.26克/厘米3;后者密度4.28克/厘米3。第一电离能为9.752电子伏特。
硒在空气中燃烧发出蓝色火焰,生成二氧化硒(SeO₂)。也能直接与各种金属和非金属反应,包括氢和卤素。不能与非氧化性的酸作用,但它溶于浓硫酸、硝酸和强碱中。溶于水的硒化氢能使许多重金属离子沉淀成为微粒的硒化物。硒与氧化态为+1的金属可生成两种硒化物,即正硒化物(M2Se)和酸式硒化物(MHSe)。正的碱金属和碱土金属硒化物的水溶液会使元素硒溶解,生成多硒化合物(M2Sen),与硫能形成多硫化物相似。
有结晶形和无定形两种同素异形体。电离能9.009电子伏特。结晶碲具有银白色的金属外观,密度6.25克/厘米3,熔点452℃,沸点1390℃,硬度是2.5(莫氏硬度)。不溶于同它不发生反应的所有溶剂,在室温时它的分子量至今还不清楚。
无定形碲(褐色),密度6.00克/厘米3,熔点449.5±0.3℃,沸点989.8±3.8℃。碲在空气中燃烧带有蓝色火焰,生成二氧化碲;可与卤素反应,但不与硫、硒反应。溶于硫酸、硝酸、氢氧化钾和氰化钾溶液。易传热和导电。
碲
元素来源:碲是稀散金属之一,有两种同素异形体,一种为结晶形、具有银白色金属光泽;另一种为无定形,为黑色粉末。结晶形碲的熔点为449.8℃,密度为6.24克/厘米3。性脆。碲的化学性质与硒相似,在空气或氧中燃烧生成二氧化碲,发出蓝色火焰;易和卤素剧烈反应生成碲的卤化物,在高温下不与氢作用。
从电解铜的阳极泥和炼锌的烟尘等中回收制取。
钋
密度9.4克/立方厘米。熔点254℃,沸点962℃。所有钋的同位素都是放射性的。已知有两种同位素异形体:α-Po为单正方体;β-Po为单菱形体。在约36℃时,发生α-Po转化为β-Po的相变。金属、质软。物理性质似铊、铅、铋。化学性质近似碲。溶于稀矿酸和稀氢氧化钾。钋的化合物易于水解并还原。化合价已有+2和+4价,也有+6价存在。钋是世界上最稀有的元素。
钋同位素中最普遍、最易得的是钋-210,其半衰期仅有138天,其放射性比镭大近5000倍。钋-210危险性很大,在操作时即便是很小量也要格外小心谨慎。
化学性质
相似性
能与大多数金属反应;
均能与氢化合生成气态氢化物;
均能在氧气中燃烧;
氧化物对应的水化物为酸;
都具有非金属性。
递变性
气态氢化物的稳定性逐渐减弱;
气态氢化物的还原性逐渐增强;
气态氢化物水溶液的酸性逐渐增强;
最高价氧化物对应水化物酸性逐渐减弱;
非金属性逐渐减弱;
氧化物的碱性逐渐增强,并出现两性
化合物
常见的氧族元素的化合物有:氧化物、硫化物、硫酸盐、亚硫酸盐、硒酸盐、碲酸盐。下文将列举出一些常见的化合物。
二氧化硫
二氧化硫(化学式:SO₂)是最常见的硫氧化物。无色气体,有强烈刺激性气味。大气主要污染物之一。火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。由于煤和石油通常都含有硫化合物,因此燃烧时会生成二氧化硫。当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分。若把SO₂进一步氧化,通常在催化剂如二氧化氮的存在下,便会生成硫酸。
二氧化硫可以通过硫的燃烧取得:S+O2==点燃==SO2;也可以通过铜和浓硫酸反应制得:Cu+2H₂SO4(浓)—Δ→CuSO4+SO2↑+2H2O。实验室则用稀硫酸和亚硫酸钠制备:H₂SO4+Na₂SO3==Na2SO4+SO₂↑+H₂O.
SO2是酸性氧化物,具有酸性氧化物的通性。可以与水作用得到二氧化硫水溶液,即“亚硫酸”(中强酸),但溶液中不存在亚硫酸分子。SO2与碱反应形成亚硫酸盐和亚硫酸氢盐。以与氢氧化钠的反应为例,产物是Na2SO3还是NaHSO3,取决于二者的用量关系。二氧化硫和碱性氧化物反应生成盐。
SO2有还原性,可以和氧化性物质如氯气反应:SO2+Cl2==SO2Cl2,在有水存在时,则:SO2+Cl2+2H2O==H2SO4+2HCl;二氧化硫可以被氧气氧化生成三氧化硫。二氧化硫可以被硝酸、高锰酸钾、溴等氧化。
SO2也有氧化性,可以和还原性物质反应,如硫化氢:2H2S+SO2==2H2O+3S.
SO2有漂白性,它的漂白作用是由于与某些有色物质生成不稳定的无色物质,但这种无色物质容易分解使物质恢复原来的颜色,但这只是暂时的,如被二氧化硫漂白的品红加热可以恢复颜色。工业上用二氧化硫漂白纸张,所以,纸张久置后,会逐渐变黄,这是因为失去了二氧化硫的缘故。SO2的漂白属于化学变化。
液态的SO2可以发生自偶电离:2SO2→SO(2+)+SO3(2-)。
硫化氢
硫化氢是一种无机化合物,化学式为H2S。正常情况下是一种无色、易燃的酸性气体,浓度低时带恶臭,气味如臭蛋;浓度高时反而没有气味(因为高浓度的硫化氢可以麻痹嗅觉神经)。它能溶于水,0°C时1体积水能溶解2.6体积左右的硫化氢。硫化氢的水溶液叫氢硫酸,是一种弱酸,当它受热时,硫化氢又从水里逸出。硫化氢是一种急性剧毒,吸入少量高浓度硫化氢可于短时间内致命。低浓度的硫化氢对眼、呼吸系统及中枢神经都有影响。
硫化氢自然存在于原油、天然气、火山气体和温泉之中。它也可以在细菌分解有机物的过程中产生。
硫化氢是酸性的,它与碱及一些金属(如银)有化学反应。例如:硫化氢和银接触后,会产生黑褐色的硫化银:H2S + 2Ag → Ag2S + H2↑ .硫化氢有还原性,可以和二氧化硫发生氧化还原反应。(见本词条→化合物→二氧化硫)。
实验室制取硫化氢:FeS+2HCl=FeCl2+H2S↑:此外,硫化氢还可以通过一些硫化物(如硫化铝)的水解制取:6H2O+Al2S3=3H2S↑+2Al(OH)3.
三氧化硫
三氧化硫是一种硫的氧化物,分子式为SO3。它的气体形式是一种严重的污染物,是形成酸雨的主要来源之一。三氧化硫中,硫的氧化数为+6,分子为非极性分子。三氧化硫的熔点很低,只有16.9℃,沸点也只有45℃。
SO3是硫酸(H2SO4)的酸酐。因此,可以发生以下反应:SO3+H2O==H2SO4,这个反应进行得非常迅速,而且是放热反应。在大约~340°C以上时,硫酸、三氧化硫和水才可以在平衡浓度下共存。
实验室通常通过热分解硫酸氢钠来制取三氧化硫:2NaHSO4-315°C→Na2S2O7+H2O ;Na2S2O7 -460°C→ Na2SO4+SO3 。此外,三氧化硫还可以通过二氧化氮和二氧化硫来制取:SO2+NO2==SO3+NO.
硫酸
硫酸(Sulfuric acid),分子式为H2SO4,是一种无色粘稠高密度的强腐蚀性液体。是一种重要的化工原料,又称化学工业之母,也是一种常见的化学试剂。硫酸具有极强的腐蚀性,因此在使用时应非常小心。
硫酸的熔点为10℃,沸点290℃,和水混溶。
硫酸溶于水强烈放热,因此在稀释硫酸的时候要注意“酸入水”。
浓硫酸有脱水性,如将浓硫酸滴在蔗糖上,白色的糖逐渐转成黑色,并释出白色的气体(水蒸汽蒸发至空气中后冷凝成的水珠):C12H22O11→12 C+11H2O 。
浓硫酸有吸水性,可以强烈的吸收水份放出热量。(如果吸收的是水分子,那么是吸水性,如吸收五水硫酸铜中的五分子的水。)
浓硫酸有酸性和氧化性,其氧化性一般要在加热的情况下才能体现出来。如,浓硫酸可以氧化单质铜;Cu+2H2SO4→CuSO4 +SO2+2H2O;浓硫酸氧化金属不放出氢气,而放出二氧化硫。浓硫酸也能氧化非金属如磷、硫、硒、碳等。
稀硫酸和活泼金属反应放出氢气,如锌和硫酸反应生成硫酸锌和氢气(Zn+H2SO4==ZnSO4+H2↑),这一反应在实验室用来制取氢气。硫酸能和金属氧化物反应:CuO+H2SO4==CuSO4+H2O(这种制取硫酸铜的方式比用浓硫酸直接氧化铜要环保)。硫酸可以和某些盐反应:BaCl2+H2SO4==BaSO4↓+2HCl。硫酸的酸性可以使石蕊溶液变红。
六氟化硫
六氟化硫(SF6)是一个无色、无味、无毒的气体,不可燃,微溶于水。分子为八面体构型,属于超价分子,无极性。六氟化硫是常用的致冷剂,但它也是很持久的温室气体,效果是二氧化碳的22,200倍。
六氟化硫由单质化合制取,反应也会生成硫的其他氟化物如十氟化二硫,可通过加热使其歧化后,再用氢氧化钠处理除去剩余的四氟化硫而纯化。六氟化硫是个极为惰性的气体,不与水、盐酸、氢氧化钠和熔融的钠作用,但会与金属锂反应并放热。
人吸入六氟化硫后声音变粗,因为六氟化硫气体的重量使人的声带中声波的速度降低一半,与吸入氦气后声音变细正好相反。
二氯化二硫
二氯化二硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟。遇水分解为硫、二氧化硫、氯化氢。溶于醚、苯、二硫化碳。室温下稳定,100°C时分解为相应单质,300°C时则完全分解。二氯化二硫能被金属还原为氯化物和硫化物。与氯气反应生成二氯化硫。能与金属氧化物或硫化物反应生成金属氯化物。
制备:由硫与限量氯气在50~60°C反应16~20小时而得:2S+Cl2==S2Cl2。二硫化碳与氯气在95~100°C反应制取四氯化碳,副产二氯化二硫:CS2+3Cl2==CCl4+S2Cl2。
用途:用作橡胶的低温硫化剂和粘结剂。在有机合成中用于引入C–S键。在氯化铝存在下,与苯反应生成二苯硫醚。与乙烯反应生成芥子气。也是Herz反应中的试剂。
硫酰氯
硫酰氯(又名磺酰氯)是硫酸的两个-OH基团被氯替代后形成的化合物,分子式为SO2Cl2,为无色有强烈刺鼻气味的液体,在潮湿空气中发烟,其沸点为69.1℃。它用作有机化学中的氯化试剂,可以将烷烃、烯烃、炔烃及芳香化合物的C-H键转化为C-Cl键,将醇转化为氯代烃。反应由偶氮二异丁腈引发,是自由基机理,称为氯磺化反应。硫酰氯也用于药物和染料的制取。
硫酰氯分子为畸变的四面体结构,硫为+6氧化态,S-O键含有一定的双键成分。在催化剂如活性炭、氯化铁或樟脑的存在下,二氧化硫与氯气化合即生成硫酰氯,通过蒸馏提纯。反应式:SO2 + Cl2 → SO2Cl2 。氯磺酸加热也可得到硫酰氯:2ClSO3H → SO2Cl2 + H2SO4 。
硫酰氯极易水解,生成氯化氢(盐酸)和硫酸:2 H2O + SO2Cl2 → 2 HCl + H2SO4
硫酰氯在100°C以上便开始分解,得到二氧化硫与氯气,使试剂变黄。长期放置时也会发生分解。
氯化亚砜
氯化亚砜,又名亚硫酰氯,是一种无机化合物,化学式是SOCl2。常温常压下,它是无色、可蒸馏的液体,140°C时分解。SOCl2有时易与硫酰氯(SO2Cl2)相混淆,但它们的化学性质差别很大。氯化亚砜的分子构型为锥体型,其中硫(VI)中心含有一对孤对电子。而光气则是平面构型。
氯化亚砜与水反应生成氯化氢和二氧化硫:H2O + SOCl2=SCl2 → SO2 + 2 HCl
由于氯化亚砜与水强烈反应,SOCl2不会在自然界存在。
氯化亚砜是无色或淡黄色发烟液体,有强刺激性气味。遇水或醇分解成二氧化硫和氯化氢。对有机分子中的羟基有选择性取代作用。本产品可溶于苯、氯仿、二硫化碳和四氯化碳。加热至150°C开始分解,500°C分解完全。
在工业上,氯化亚砜主要由三氧化硫和二氯化硫反应制得:SO3 + SCl2 → SOCl2 + SO2。
硫酸铜
硫酸铜,化学式CuSO4,为白色粉末,其常见的形态为其结晶体,五水合硫酸铜(CuSO4·5H2O),为蓝色固体。其水溶液因水合铜离子的缘故而呈现出蓝色,故在实验室里无水硫酸铜常被用于检验水的存在。在现实生产生活中,硫酸铜常用于炼制精铜,与熟石灰混合可制农药波尔多液。硫酸铜属于重金属盐,
有毒,成人致死剂量0.9g/kg。若误食,应立即大量食用牛奶、鸡蛋清等富含蛋白质食品,或者使用EDTA钙钠盐解毒。用途:
灭菌剂:硫酸铜可以用于杀灭真菌。与石灰水混合后生成波尔多液,用于控制柠檬、葡萄等作物上的真菌。稀溶液用于水族馆中灭菌,以及除去蜗牛。由于铜离子对鱼有毒,用量必须严格控制。大多数真菌只需非常低浓度的硫酸铜就可被杀灭。此外,硫酸铜也可用来控制大肠杆菌。
分析试剂:几种化学分析都需用到硫酸铜。它用于斐林试剂和班氏试剂中检验还原糖。在反应中,二价铜离子被还原成一价的不溶红色沉淀氧化亚铜。硫酸铜还可用于双缩脲试剂中用来检测蛋白质。
硫酸铜可用于检验贫血。将血样滴入硫酸铜溶液中,若血样中含足够血红蛋白,血样会快速下沉;若血红蛋白含量不够,血样会悬浮在溶液中。
焰色反应中硫酸铜显蓝绿色,比钡离子的颜色蓝得多。
有机合成:硫酸铜可以用于有机合成。无水盐用于催化转缩醛反应。五水盐与高锰酸钾反应生成一种氧化剂,用于伯醇的转换。
化学教学:硫酸铜可用于晶体的生成试验和电镀铜实验。硫酸铜也常用于演示放热反应,演示时将镁条插入硫酸铜溶液中。硫酸铜还可以用来演示晶体失水风化和得到结晶水的过程。中学课本上有个用铁置换铜的实验,是将铁条(或铁丝)插入硫酸铜溶液中,可以置换出红色的铜。
二氧化硒
二氧化硒(化学式:SeO2)是硒(IV)的氧化物,无色晶体,是最常用的硒化合物,315℃升华,有毒,人摄入后体内会散发出特别的臭味(摄入后应服用维生素C)。
硒在空气中燃烧(蓝色火焰),硒与硝酸、过氧化氢反应氧化,或亚硒酸脱水都可以得到二氧化硒。二氧化硒可溶于水,生成亚硒酸;溶于碱则生成亚硒酸盐。它是有机合成中的氧化剂,可用于烯丙位氧化、Riley氧化反应等。环己酮发生反应得到1,2-环己二酮,三聚甲醛反应得到乙二醛。
硒化氢
硒化氢是一种极毒、有恶臭的无色气体,酸性比硫化氢强,加热灼烧可逐渐分解。可燃。通常由金属硒化物和水或稀酸的反应制取。
其他硒化合物
亚硒酸是硒的含氧酸的一种,其中硒的氧化态为+4。它是白色正交晶系晶体,极易溶于水,由二氧化硒溶于少量水缓慢蒸发结晶并用氢氧化钾干燥得到。晶体中稍许畸变的SeO3基团,靠较强的氢键相互连接。固态亚硒酸在150℃分解。在更强的氧化剂(如臭氧、氯气、高锰酸根离子)作用下,亚硒酸也可以被氧化为硒酸。亚硒酸有很高毒性,中毒症状可能延迟数小时,包括昏迷、恶心、低血压,严重时可能致死。
硒酸是硒的含氧酸的一种,其中硒的化合价的氧化态为+6,有很强的氧化性,可以溶解金。
二硒化碳(化学式:CSe2,是一种黄色且有刺激性气味的液体。和二氧化碳、二硫化碳一样,二硒化碳也被认为是一种无机化合物。二硒化碳可在550℃以下借由硒粉与二氯甲烷反应制得:2 Se + CH2Cl2 → CSe2 + 2 HCl ↑.
其他碲化合物
碲化氢是无色、有恶臭、极毒的无色气体,不稳定,加热分解,有较强的还原性,可以被一些常见的氧化剂氧化。
三氧化碲〔TeO3〕是一种无机化合物。碲的化合价为+6。三氧化碲有两种形式,一种是红色的α-TeO3,一种是灰色的β-TeO3。
二氧化碲,不溶于水的固体。
原碲酸是可溶于水、易溶于热水的白色晶体,化学式H6TeO6,是很弱的二元酸(电离常数为K1=2.09X10^-8,K2=6.46X10^-12),一般只有2个氢原子会被取代,但也有个别情况6个氢原子都能被取代。原碲酸加热分解出三氧化碲。原碲酸是弱酸。原碲酸有强氧化性,能溶解银,和浓盐酸的混酸(存在游离Cl2)能溶解铂和金,本身被还原成二氧化碲。SO2或N2H4能将原碲酸还原成单质碲。
碲酸钡,由二氧化碲和过氧化钡反应产生,与钼酸钡为同晶型。
参考
氮族元素(Pnictogen、Nitrogen group)
卤族元素(Halogen)
稀有气体(Noble gas)
参考资料
1.氧族元素详细资料大全·历史新知