sp3杂化(轨道杂化方式)
温馨提示:这篇文章已超过506天没有更新,请注意相关的内容是否还可用!
sp3杂化
轨道杂化方式
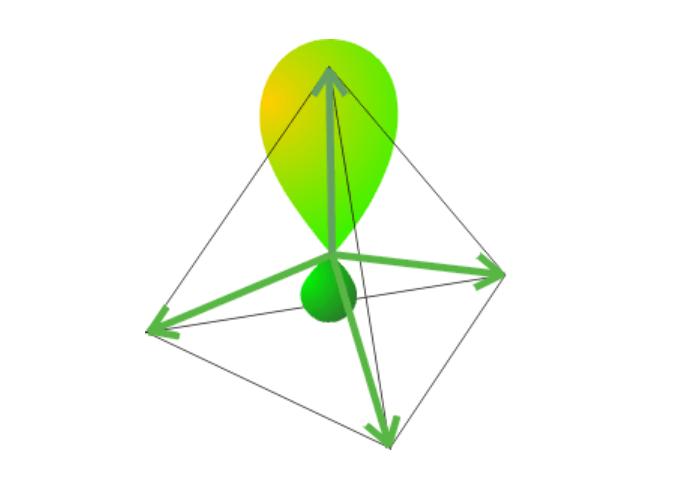
同一原子内由1个ns轨道和3个np轨道参与的杂化称为sp3杂化,所形成的4个杂化轨道称sp3杂化轨道。各含有1/4的s成分和3/4的p成分,杂化轨道间的夹角为109°28',空间构型为正四面体。sp3轨道杂化是基于轨道杂化理论的一个重要分支,是一种比较常见的轨道杂化方式。
| 中文名 | sp3杂化 |
| 英文名 | sp3hybridization |
| 性质 | 原子内电子层的变化 |
| 属于 | 化学 |
简介
“杂化”是同一个原子(例如C原子)的能量相近的各个原子轨道平均混合成一组新的原子轨道的过程。杂化后的一组新轨道(仍是原子轨道),叫做“杂化轨道”。
以甲烷为例:基态C原子中已配对的2s电子拆开,其中1个电子跑到能量稍高的2p轨道中(Pz空轨道)去,这一过程叫电子跃迁;接着进行杂化,一个2S轨道和3个2P轨道杂化,生成4个能量相等的sp3杂化轨道。
因为是平均混合,每个sp3杂化轨道含有1/4s和3/4的p轨道的成份,其中各有1个成单电子。最后这4个电子再与4个H原子中的1s电子配对成σ(sigma)键,从而形成CH4。
原因
降低体系能量使之更加稳定。
能量相近的几个轨道结合在一起形成一种新的轨道以增强成键能力,使之更稳定。
例子
CH4、CCl4、(正四面体)、NH4+。
NH3(三角锥型)、H2O(V型)等也是sp3杂化,只不过是sp3不等性杂化。
原理研究
以强σ键连接的sp2和sp3杂化碳饱和簇模型,即金刚石和石墨两相和团簇模型为研究对象,通过分子结构、电荷分布、能带结构、电子态密度和分子轨道的第一性原理计算和分析,研究了类金刚石薄膜中sp2-sp3轨道杂化的空间结构稳定性的成键特性等。
结果表明,成键过程中由于微扰作用破坏了原子内部"吸引"与"排斥"的平衡关系,使电子云重新分布,而键能大小和电子云的重叠密切相关,因而两相共存对电荷分布和结构均有影响。
能带结构分析发现sp2杂化C原子将π键引入,产生π和π*能带使带隙变窄,说明类金刚石薄膜的半导体本质。电子态密度计算结果中费米能级附近出现杂质峰,说明存在中间杂化和/或π态和σ态的转化。
参考资料
1.类金刚石薄膜sp~2-sp~3轨道杂化的第一性原理研究·知网空间