氯气(强烈刺激性气味的有毒气体)
温馨提示:这篇文章已超过478天没有更新,请注意相关的内容是否还可用!
氯气
强烈刺激性气味的有毒气体
黄绿色有刺激性气味的气体。在高压或冷冻条件下为琥珀色液体。主要应用于有机和无机氯化物的制造,杀虫剂,溶剂,消毒剂,漂白剂,去污剂,生产甘油、塑料等,香料.农药。药品,冶炼,橡胶,干刻,光纤维,晶体生长,热氧化,标准气,校正气。氯混合5%(体积)以上氢气时有爆炸危险。氯气具有毒性,主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,会对上呼吸道黏膜造成损害。氯能与有机物和无机物进行取代或加成反应生成多种氯化物。氯气能与有机物和无机物进行取代反应和加成反应生成多种氯化物。氯气在早期作为造纸、纺织工业的漂白剂。
| 中文名 | 氯气 |
| 化学式 | Cl2 |
| 分子量 | 71 |
| 熔点 | -101℃ |
| 沸点 | -34℃ |
| 水溶性 | 可溶于水 |
| 密度 | 3.21kg/m³ |
| 外观 | 常温常压下为黄绿色的有毒气体 |
| 应用 | 杀菌,消毒 |
| 危险性符号 | 剧毒气体 |
| 危险性描述 | 混和体积分数为5%以上的氢气时遇强光可能会有爆炸的危险 |
| 英文名 | chlorine |
概述
氯气,是具有异臭和强烈刺激性的黄绿色气体,有窒息性气味。其遇水生成次氯酸和盐酸,与一氧化碳在高热条件下,可生成光气。
氯气在日光下与易燃气体混合时会发生燃烧爆炸,在高压下液化为液态氯。氯气易溶于水和碱溶液,也易溶于二硫化碳和四氯化碳等有机溶剂。其遇水首先生成次氯酸和盐酸,次氯酸又可再分解为氯化氢和新生态氧,因此它是强氧化剂和漂白剂。
氯气是有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,会对上呼吸道黏膜造成有害的影响。
发现历史

氯气的发现应归功于瑞典化学家舍勒。
舍勒是18世纪中后期欧洲的一位相当出名的科学家,他从少年时代起就在药房当学徒,他迷恋实验室工作,在仪器、设备简陋的实验室里他做了大量的化学实验,涉及内容非常广泛,发明也非常多。他以其短暂而勤奋的一生,对化学做出了突出的贡献,赢得了人们的尊敬。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰)。当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使舍勒感到极为难受。
舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属或金属氧化物发生化学反应。从1774年舍勒发现氯气以后,到1810年,许多科学家先后对这种气体的性质进行了研究。这期间,氯气一直被当作一种化合物。直到1810年,戴维经过大量实验研究,才确认这种气体是由一种化学元素组成的物质。他将这种元素命名为chlorine。这个名称来自希腊文,有“绿色的”意思。中国早年的译文将其译作“绿气”,后改为氯气。
自然分布
自然界中游离状态的氯存在于大气层中,是破坏臭氧层的主要单质之一。氯气受紫外线分解成两个氯原子(自由基)。大多数通常以氯化物(Cl)的形式存在,常见的主要是氯化钠(食盐,NaCl)。
物理性质
状态
 氯气的电子式
氯气的电子式通常情况下为有强烈刺激性气味的黄绿色的有毒气体。
密度
氯气密度是空气密度的2.5倍,标况下ρ=3.21kg/m³。
易液化
熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯,液氯即Cl₂,液氯是一种油状的液体,其与氯气物理性质不同,但化学性质基本相同。
溶解性
可溶于水,且易溶于有机溶剂(例如:四氯化碳),难溶于饱和食盐水。1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为3.170g/L,比空气密度大。
结构
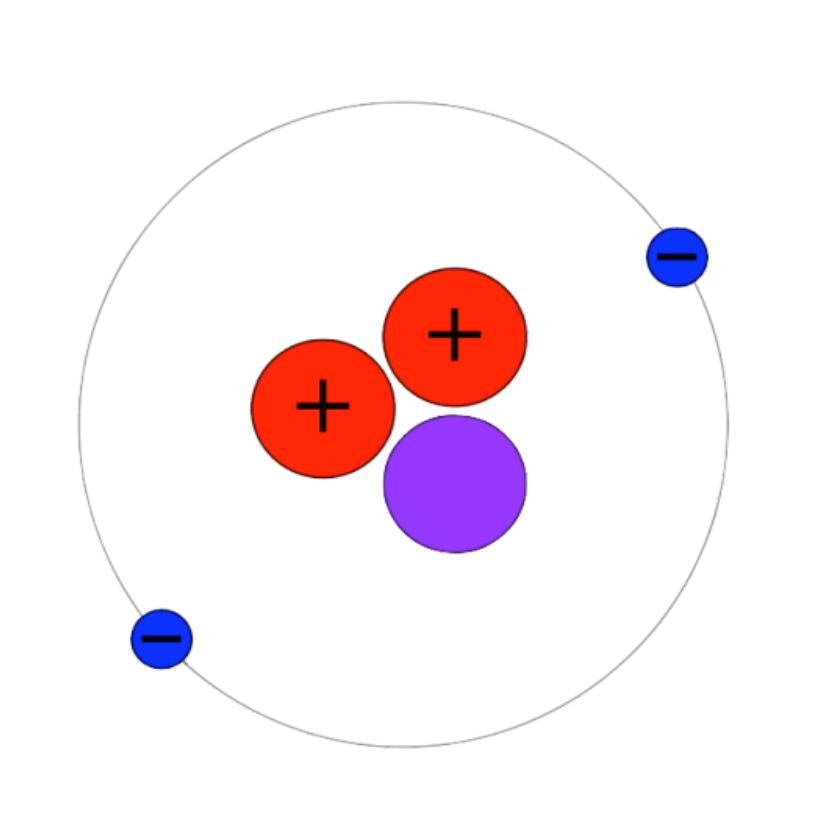
原子结构:氯原子最外层有7个电子,反应中易得到1个电子或共用一个电子对达到稳定结构(共价键)
分子结构:氯分子为双原子分子,分子式Cl₂。
离子结构:氯离子最外层有8个电子,因而很稳定。
化学性质
毒性
氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成损伤:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。症状重时,会发生肺水肿,使循环作用困难而致死亡。由食道进入人体的氯气会使人恶心、呕吐、胸口疼痛和腹泻。1L空气中最多可允许含氯气0.001mg,超过这个量就会引起人体中毒。
金属
1、金属钠在氯气中燃烧生成氯化钠。
现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热。
2、铜在足量氯气中燃烧生成氯化铜。
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色(绿色较明显),加足量水后,溶液完全显蓝色。
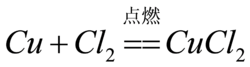 氯气
氯气3、铁在氯气中燃烧生成三氯化铁。
 氯气与铁的反应演示
氯气与铁的反应演示现象:铁丝在氯气里剧烈燃烧,瓶里充满棕红色烟,加少量水后,溶液呈黄色。
4.镁带在氯气中燃烧生成氯化镁。
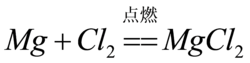 氯气
氯气注:氯气具有强氧化性,加热下可以与所有金属反应,如金、铂在热氯气中燃烧,而与Fe、Cu等变价金属反应则生成高价金属氯化物。
常温下,干燥氯气或液氯不与铁反应,只能在加热情况下反应,所以可用钢瓶储存氯气(液氯)。
非金属
1、与氢气的反应
H₂+Cl₂=点燃=2HCl(工业制盐酸方法,工业先电解饱和食盐水,生成的氢气和氯气燃烧生成氯化氢气体。)
现象:H₂在Cl₂中安静地燃烧,发出苍白色火焰,瓶口处出现白雾。
H₂+Cl₂=光照=2HCl
现象:见光爆炸,有白雾产生。
需要注意的是:将点燃的氢气放入氯气中,氢气只在管口与少量的氯气接触,产生少量的热;点燃氢气与氯气的混合气体时,大量氢气与氯气接触,迅速化合放出大量热,使气体急剧膨胀而发生爆炸。工业上制盐酸使氯气在氢气中燃烧。氢气在氯气中爆炸极限是9.8%~52.8%
2、与磷的反应
2P+3Cl₂(少量)==2PCl₃(液体农药,雾)
2P+5Cl₂(过量)==2PCl(固体农药,烟)
现象:产生白色烟雾.
3、与其他非金属的反应
实验证明,在一定条件下,氯气还可与S、Si等非金属直接化合。
2S+Cl₂=点燃=S₂Cl₂
水
在该反应中,氧化剂是Cl₂,还原剂也是Cl₂,本反应是歧化反应。
氯气遇水会产生次氯酸,次氯酸具有净化(漂白)作用,用于消毒——溶于水生成的HClO具有强氧化性。
化学方程式是:
Cl₂+H₂O=HCl+HClO(可逆反应)
家用84消毒液与洁厕液混用会导致氯气中毒的原理就是此反应的逆反应。因为84消毒液的主要成分为NaClO,洁厕液的主要成分为盐酸,两者相遇会产生大量热,并放出氯气。
二氧化硫与水
SO₂+Cl₂+2H₂O=H₂SO₄+2HCl
碱溶液
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl₂+Ca(ClO)2+2H2O
上述两反应中,Cl₂作氧化剂和还原剂,是歧化反应。
Cl2+2OH-(冷)=ClO-+Cl-+H2O
3Cl2+6OH-(热)=ClO3-+5Cl-+3H2O
盐溶液
Cl2+2FeCl2=2FeCl3
Cl2+Na2S=2NaCl+S(中学阶段用来证明氯气非金属性和氧化性比硫强。)
气体
Cl的化学性质比较活泼,容易与多种可燃性气体发生反应。
如:CH、H₂、C₂H₂等。
有机物
甲烷的取代反应:
CH₄+Cl₂=光照=CH₃Cl+HCl
CH₃Cl+Cl₂==CH₂Cl₂+HCl
CH₂Cl₂+Cl₂==CHCl₃+HCl
CHCl₃+Cl₂==CCl₄+HCl
加成反应:
CH₂=CH₂+Cl₂==CH₂ClCH₂Cl(1,2-二氯乙烷)
和二硫化碳反应:
CS+3Cl=95~100℃=CCl+SCl
主要用途
用途概述
①消毒(自来水常用氯气消毒,1L水里约通入0.002g氯气,消毒原理是其与水反应生成了次氯酸,它的强氧化性能杀死水里的病菌。而之所以不直接用次氯酸为自来水杀菌消毒,是因为次氯酸易分解难保存、成本高、毒性较大,则用氯气消毒可使水中次氯酸的溶解、分解、合成达到平衡,浓度适宜,水中残余毒性较少。)
②制盐酸
③工业用于制漂白粉或漂粉精。
④制多种农药(如六氯环己烷,俗称666。)
⑤制氯仿、四氯化碳等有机溶剂
⑥制塑料(如聚氯乙烯塑料)等Cl₂可用来制备多种消毒剂,含Cl的消毒剂有ClO₂,NaClO,Ca(ClO)₂。
⑦常用于将FeCl₂氧化成FeCl₃
⑧工业用于海水提溴(Cl₂+2NaBr==Br₂+2NaCl)
漂白
Cl制成的漂白物很多,一般生活中涉及两种,NaClO和Ca(ClO)₂
一般来说,消毒液是NaClO,因为其稳定,所以是液态,一般用氯气通入氢氧化钠中制得。但其价格较高,工业漂白不用,常见于84。
消毒粉则是Ca(ClO)₂,因为其不够稳定一般为固体,是氯气通入石灰乳中制得,价格低廉,用于工业漂白,使用方法是加水溶解有效成分是次氯酸钙,从而漂白。
保存以上漂白剂时,注意密封干燥,避免阳光直射。因为次氯酸盐在空气中会与二氧化碳、水发生反应,产生次氯酸,次氯酸在光照下分解,从而导致漂白剂失效。
制取方法
电解
1.工业生产中用直流电电解饱和食盐水法来制取氯气:
2NaCl+2H₂O=通电=H₂↑+Cl₂↑+2NaOH
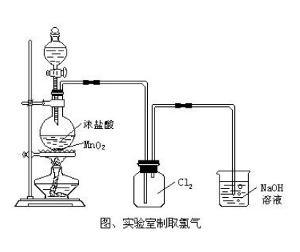
2.实验室通常用氧化浓盐酸的方法来制取氯气:
常见的氧化剂有:MnO₂、K₂Cr₂O₇(重铬酸钾)、KMnO₄、Ca(ClO)₂、CoO
发生的反应分别是:
4HCl(浓)+MnO₂=加热=MnCl₂+Cl₂↑+2H₂O
14HCl+K₂Cr₂O₇=2KCl+2CrCl₃+7H₂O+3Cl₂↑
16HCl+2KMnO₄=2KCl+2MnCl₂+8H₂O+5Cl₂↑
4HCl+Ca(ClO)₂=CaCl₂+2H₂O+2Cl₂↑{此反应需要的盐酸很稀,1mol/L便可以剧烈反应。}
H++ClO-+Cl-=H2O+Cl2↑
{只要能电离出H的酸即可参加并且发生此归中反应;如:草酸。但由于参加反应的酸电离出的H能力的不同,反应的速率也会不同。如果此酸为有机酸,且易挥发,那么要注意不能在强光照的照射下反应,不然氯气可能会和挥发出来的有机酸发生取代反应发生爆炸或生成有毒物质,如:冰醋酸会和氯气发生取代反应生成氯醋酸(剧毒固体)、二氯醋酸(固体)、三氯醋酸(固体)}
如不用浓盐酸,亦可用NaCl(固体)跟浓硫酸来代替.如:
2NaCl+3H₂SO₄(浓)+MnO₂=加热=2NaHSO₄+MnSO₄+2H₂O+Cl₂↑
因为会生成大量难以分离且易爆炸的ClO。
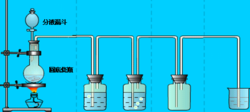 氯气实验
氯气实验总之,实验室制氯气的办法都围绕着一个核心:氯离子+氧化剂+酸性环境,氧化剂的氧化性不强的话还需不同程度加热。
相关口诀
二氧化锰盐酸逢,隔网热瓶氯气生。
盐水硫酸除杂质,吸收通入火碱中。
解释
(1)二氧化锰盐酸逢,隔网热瓶氯气生:这句的意思是说在实验室中是用二氧化锰与浓盐酸在烧瓶中隔石棉网加热的方法来制取氯气。
(2)盐水硫酸除杂质:“盐水”指饱和食盐水,“杂质”指混在氯气中的氯化氢和水蒸气。这句的意思是说使气体依次通过饱和食盐水和浓硫酸分别除掉混在氯气中的氯化氢和水蒸气。
(3)吸收通入火碱中:的意思是说多余的氯气必须通入火碱溶液中吸收掉(因为氯气有毒)。
尾气处理及离子反应
用NaOH溶液。
2OH+Cl₂=Clˉ+ClOˉ+H₂O
第一个瓶子内的是饱和食盐水是为了除盐酸。
第二个是浓硫酸是为了除水蒸气。
物质特性
物理性质
①颜色气味状态:通常情况下为有刺激性气味的黄绿色的气体,剧毒。
②密度:比空气密度大,密度为3.170g/L
③易液化。熔沸点较低,压强为101kPa、温度为-34.6℃时易液化。液态氯为金黄色。如果将温度继续冷却到-101℃时,液氯变成固态氯。
④溶解性:易溶于有机溶剂,难溶于饱和食盐水。1体积水在常温下可溶解2体积氯气,形成氯水。
化学性质
化学式:Cl2
①毒性
氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成有害的影响:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。症状重时,会发生肺水肿,使循环作用困难而致死亡。由食道进入人体的氯气会使人恶心、呕吐、胸口疼痛和腹泻。1L空气中最多可允许含氯气0.001毫克,超过这个量就会引起人体中毒。
②助燃性
在一些反应中,氯气可以支持燃烧
铜在氯气中燃烧生成氯化铜
化学方程式:Cu+Cl2=CuCl2(条件:点燃)
现象:铜剧烈燃烧并生成棕黄色烟
铁在氯气中燃烧生成氯化铁
化学方程式:2Fe+3Cl2=2FeCl3(条件:点燃)
现象:剧烈燃烧并生成棕褐色烟
氢气在氯气中燃烧生成氯化氢
化学方程式:H2+Cl2=2HCl(条件:点燃)
现象:剧烈燃烧产生苍白色火焰
注:氯气具有强氧化性,因此,产物中像Fe、Cu这样的变价金属的化合价表现为最高价。
③与金属反应
钠在氯气中燃烧生成氯化钠
化学方程式:2Na+Cl2=2NaCl(条件:点燃)
现象:钠剧烈燃烧并产生白烟
注:氯气具有强氧化性,因此,产物中像Fe、Cu这样的变价金属的化合价表现为最高价。
④与非金属反应
氢气在氯气中燃烧或受到光照生成氯化氢气体
化学方程式:H2+Cl2=2HCl(条件:点燃或光照)
现象:燃烧发出苍白色火焰,光照时会发生爆炸现象
⑤与水反应
在该反应中,氧化剂是Cl2,还原剂是Cl2,在水中有歧化现象。
化学方程式是:Cl2+H2O=HCl+HClO
⑥与碱溶液反应
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
上述两反应中,Cl2作氧化剂和还原剂,有歧化现象。
物质毒性
文献、期刊报道的毒性作用试验数据
编号 | 毒性类型 |
1 | 急性毒性 |
2 | 急性毒性 |
3 | 急性毒性 |
4 | 急性毒性 |
5 | 急性毒性 |
6 | 急性毒性 |
7 | 急性毒性 |
8 | 急性毒性 |
9 | 急性毒性 |
10 | 慢性毒性 |
11 | 慢性毒性 |
12 | 慢性毒性 |
13 | 慢性毒性 |
14 | 慢性毒性 |
15 | 慢性毒性 |
16 | 慢性毒性 |
17 | 慢性毒性 |
18 | 慢性毒性 |
19 | 慢性毒性 |
20 | 慢性毒性 |
21 | 突变毒性 |
22 | 突变毒性 |
23 | 突变毒性 |
24 | 致癌性 |
25 | 致癌性 |
26 | 生殖毒性 |
生产技术
技术发展史
氯气的生产方法经历了漫长的发展过程.1774年瑞典化学家舍勒用软锰矿(含有二氧化锰)和浓盐酸作用,首先制得了氯气:
4HCl(浓)+MnO₂=加热=MnCl₂+2H₂O+Cl₂↑
然而,由于当时还不能够大量制得盐酸,故这种方法只限于实验室内制取氯气.后来法国化学家贝托雷把氯化钠、软锰矿和浓硫酸的混合物装入铅蒸馏器中,经过加热制得了氯气:
2NaCl+3H₂SO₄(浓)+MnO₂=加热=2NaHSO₄+MnSO₄+2H₂O+Cl₂↑
因为此法原料易得,所以,自1774年舍勒制得氯气到1836年止,人们一直沿用贝托雷发明的方法来生产氯气。
1836年古萨格发明了一种焦化塔,用来吸收路布蓝法生产纯碱(Na₂CO₃)的过程中排出的氯化氢气体(以前这种含氯化氢的气体被认为是一种废气,从古萨格开始,才得到了充分利用)得到盐酸,从此盐酸才成为一种比较便宜的酸,可以广为利用.舍勒发明的生产氯气的方法,经过改进,到此时才成为大规模生产氯气的方法.
1868年狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气来氧化氯化氢气体制取氯气的方法:
4HCl+O₂=2H₂O+2Cl₂↑
这种方法被称为狄肯法(又译为地康法).
上面这些生产氯气的方法,虽然在历史上都起过一定的作用,但是它们与电解法生产氯气相比,无论从经济效益还是从生产规模上,都大为逊色.当电解法在生产上付诸实用时,上述生产氯气的方法就逐渐被淘汰了.
电解法的诞生要追溯到1833年.法拉第经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,能够获得氯气:
2NaCl+2H₂O=2NaOH+H₂↑+Cl₂↑
后来,科英国学家瓦特也发现了这种方法,并在1851年获得了一份关于生产氯气的英国专利.但是由于当时没有实用的直流发电机以产生足够的电流,所以电解法也只能停留在实验室规模,不能付诸工业生产,而被束之高阁.一直到十九世纪七十至八十年代,出现了比较好的直流发电机,电解法才得到广泛的应用。从此,氯气的工业生产跨入了一个新纪元。然而当时电解氯气所使用的电极为汞,致使电解得到的氯气、氢气中混有相当多的汞蒸气。这种“汞法制氯”对环境危害很大,所以新的“离子交换膜法”制取氯气,更环保,更节能。(汞法制氯至今仍是制取氯气的主流方法,如2010年中国有46%的氯气,2000年西欧50.1%的氯气都为此法生产的)
氯气液化

氯气通常可直接利用,但为了制取纯净的氯气,并考虑贮运的方便,而把一部分氯气进行液化制成液氯,用钢瓶或槽车运往用户。生产中,将从电解槽出来的热氯气(其中含有少量氢、氧和二氧化碳等杂质),用冷水洗涤或在换热器内冷凝脱水,再用硫酸干燥(必要时可以液氯洗涤以除去水分和杂质),然后送去液化。因湿氯对铁有腐蚀作用,液化前氯中水分应低于50ppm。
氯气液化的温度和压力范围很大,工业生产上分为低压法、中压法和高压法。低压法在氯气为0.078~0.147MPa(表压),冷却温度为-35~-40℃下进行液化。中压法在氯气为0.245~0.49MPa,冷却温度为-15~-20℃下进行液化。高压法的氯气为0.98~1.17MPa,用15~25℃水冷却即可液化。高压法比低压法能耗低,循环水用量少,但设备费用较高,适于大规模生产使用,中、小型氯碱厂多采用中压法。液化率由氯中含氢量来决定。液化尾气中含氢不得超过4%(体积)。尾气含60%~70%的氯气可作为合成盐酸、氯苯、次氯酸盐的原料气,也可经过深度净化精制,使液化率达到98%~99%。
安全贮运

液氯在生产和贮运中易发生下列问题:
①液化尾气中氯气、氢气与空气的混合气爆炸;
②包装容器中残存有机物杂质与氯气反应爆炸;
③水和食盐水溶液中铵盐带入液化系统,会使液氯中三氯化氮积累而引起爆炸。
当液氯蒸发用完后,所用容器均须用水和碱水冲洗,以除去被三氯化氮污染的液氯后,方能修理和使用。氯是剧毒物,生产中对受压容器等设备应严格要求,防止氯气泄漏。空气中氯气允许浓度不大于1ppm。
毒理学
人吸入LCLo:500ppm/5M。
大鼠吸入LC50:293ppm/1H。小鼠吸入LC50:137ppm/1H。
氯气吸入后,主要作用于气管、支气管、细支气管和肺泡,导致相应的病变,部分氯气又可由呼吸道呼出。人体对氯的嗅阈为0.06mg/m³;90mg/m³,可致剧咳;120~180mg/m³,30~60min可引起中毒性肺炎和肺水肿;300mg/m³时,可造成致命损害;3000mg/m³时,危及生命;高达30000mg/m³时,一般滤过性防毒面具也无保护作用。
中毒机理:
氯气吸入后与粘膜和呼吸道的水作用形成氯化氢和新生态氧。氯化氢可使上呼吸道粘膜炎性水肿、充血和坏死;新生态氧对组织具有强烈的氧化作用,并可形成具细胞原浆毒作用的臭氧。氯浓度过高或接触时间较久,常可致深部呼吸道病变,使细支气管及肺泡受损,发生细支气管炎、肺炎及中毒性肺水肿。由于刺激作用使局部平滑肌痉挛而加剧通气障碍,加重缺氧状态;高浓度氯吸入后,还可刺激迷走神经引起反射性的心跳停止。氯气中毒不可以进行人工呼吸。
临床表现
急性中毒主要为呼吸系统损害的表现。
a.起病及病情变化一般均较迅速。
b.可发生咽喉炎、支气管炎、肺炎或肺水肿,表现为咽痛、呛咳、咳少量痰、气急、胸闷或咳粉红色泡沫痰、呼吸困难等症状,肺部可无明显阳性体征或有干、湿性罗音。有时伴有恶心、呕吐等症状。
c.重症者尚可出现急性呼吸窘迫综合征,有进行性呼吸频速和窘迫、心动过速,顽固性低氧血症,用一般氧疗无效。
d.少数患者有哮喘样发作,出现喘息,肺部有哮喘音。
e.极高浓度时可引起声门痉挛或水肿、支气管痉挛或反射性呼吸中枢抑制而致迅速窒息死亡。
f.病发症主要有肺部继发感染、心肌损害及气胸、纵隔气肿等。
g.X线检查:可无异常,或有两侧肺纹理增强、点状或片状边界模糊阴影或云雾状、蝶翼状阴影。
h.血气分析:病情较重者动脉血氧分压明显降低。
i.心电图检查:中毒后由于缺氧、肺动脉高压以及植物神经功能障碍等,可导致心肌损害及心律失常。
眼损害:氯可引起急性结膜炎,高浓度氯气或液氯可引起眼灼伤。
皮肤损害:液氯或高浓度氯气可引起皮肤暴露部位急性皮炎或灼伤。
处理
吸入气体者立即脱离现场至空气新鲜处,保持安静及保暖。眼或皮肤接触液氯时立即用清水彻底冲洗。
吸入后有症状者至少观察12小时,对症处理。吸入量较多者应卧床休息,吸氧,给舒喘灵气雾剂、喘乐宁(Ventolin)或5%碳酸氢钠加地塞米松等雾化吸入。
急性中毒时需合理氧疗;早期、适量、短程应用肾上腺糖皮质激素;维持呼吸道通畅;防治肺水肿及继发感染。参见《急性刺激性气体中毒性肺水肿的治疗》
其他对症处理。
眼及皮肤灼伤按酸灼伤处理,参见《化学性眼灼伤的治疗》和《化学性皮肤灼伤的治疗》。
卫生标准
车间空气卫生标准:中国MAC1mg/m³;美国ACGIHTLV-STEL2.9mg/m³(1ppm);TLV-TWA1.5mg/m³(0.5ppm)
中国职业病诊断国家标准:职业性急性氯气中毒诊断标准及处理原则GB4866-1996。
危规:GB2.3类23002(液化的)。原铁规:剧毒气体,31001。UNNO.1017。IMDGCODE2028页,2类。副危险6.1。
相关仪器

1、泵吸式氯气检测仪
CY-CL2泵吸式氯气检测仪采用内置吸气泵,可快速检测工作环境中氯气浓度。泵吸式氯气检测仪采用进口电化学传感器,具有非常清晰的大液晶显示屏,声光报警提示,保证在非常不利的工作环境下也可以检测危险气体并及时提示操作人员预防。
2、便携式氯气检测仪
HFPCY-CL2便携式氯气泄漏检测仪可连续检测作业环境中氯气浓度。氯气泄漏检测仪为自然扩散方式检测气体浓度,采用进口电化学传感器,具有极好的灵敏度和出色的重复性;氯气检测仪采用嵌入式微控制技术,菜单操作简单,功能齐全,可靠性高,整机性能居国内领先水平。检测仪外壳采用高强度工程材料、复合弹性橡胶材料精制而成,强度高、手感好。
3、在线式氯气检测报警器
HFTCY-CL2在线式氯气检测报警器由气体检测报警控制器和固定式氯气检测器组成,气体检测报警控制器可放置于值班室内,对各监测点进行监测控制,氯气检测器安装于气体最易泄露的地点,其核心部件为气体传感器。氯气检测器将传感器检测到的氯气浓度转换成电信号,通过线缆传输到气体检测报警控制器,气体浓度越高,电信号越强,当气体浓度达到或超过报警控制器设置的报警点时,气体检测报警控制器发出报警信号,并可启动电磁阀、排气扇等外联设备,自动排除隐患。在线式氯气检测报警器广泛应用于石油、化工、冶金、电力、煤矿、水厂等环境,有效防止中毒事故的发生。
参考资料
1.氯气 Cl2·粤佳气体