胺(化合物)
温馨提示:这篇文章已超过431天没有更新,请注意相关的内容是否还可用!
胺
化合物
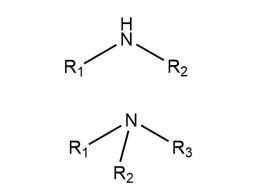
胺的释义:氨分子中的一个或多个氢原子被烃基取代后的产物,称为胺。胺可以是看作氨分子中的H被烃基取代的衍生物。根据胺分子中氢原子被取代的数目,可将胺分成伯胺、仲胺、叔胺。例如:CH3CH2NH2(伯胺)、(CH3CH2)2NH(仲胺)、(CH3CH2)3N(叔胺),氨分子中的氢被烃基取代而生成的化合物。胺类广泛存在于生物界,如蛋白质、核酸、许多激素、抗生素和生物碱等都是胺的复杂衍生物,具有极重要的生理活性和生物活性,临床上使用的大多数药物也是胺或者胺的衍生物,因此掌握胺的性质和合成方法是研究这些复杂天然产物及更好地维护人类健康的基础。
| 中文名 | 胺 |
| 化学式 | CH3CH2NH2 |
| 英文名 | amine |
| 原理 | 氨分子中的氢被烃基取代而生成 |
| 合成 | 卤化物氨解 |
词义解释
基本解释
胺(àn)氨NH3分子中部分或全部氢原子被烃基取代后而成的有机化合物,胺类大都具有碱性,能与酸结合而成盐,是制作合成染料、药物等的原料。
详细解释
胺 【名】氨分子里的氢被烃基或其他非酸性有机基取代后衍生出的一类有机化合物〖amine〗
胺 (è)【动】 肉类腐烂变臭〖(ofmeat)putrefy〗。
分类
按照氢被取代的数目,依次分为一级胺(伯胺)RNH2、二级胺(仲胺)R2NH、三级胺(叔胺)R3N、四级铵盐(季铵盐)R4N+X-,例如甲胺CH3NH2、苯胺C6H5NH2、乙二胺H2NCH2CH2NH2、二异丙胺[(CH3)2CH]2NH、三乙醇胺(HOCH2CH2)3N、溴化四丁基铵(CH3CH2CH2CH2)4N Br 。
合成
卤化物氨解(Ammonolysis of halides)
氨或胺氮上有孤对电子,作为亲核试剂与卤代烷发生亲核反应,按SN2机理进行。许多有机卤化物以氨水溶液或氨溶液处理则变成胺类。
X为卤素:
RX + NH3 → RNH3 + X-,
RNH3+X- → RNH2 + H2O + X-。
用醇制备:
胺的主要合成方法是氨的烷基化。工业上使用醇与氨合成有机胺:
ROH + NH3 → RNH2 + H2O。
这些反应需要使用催化剂、特制仪器及额外纯化,因为得到的是一、二、三级胺的混合物,需要提高反应的选择性。
性质
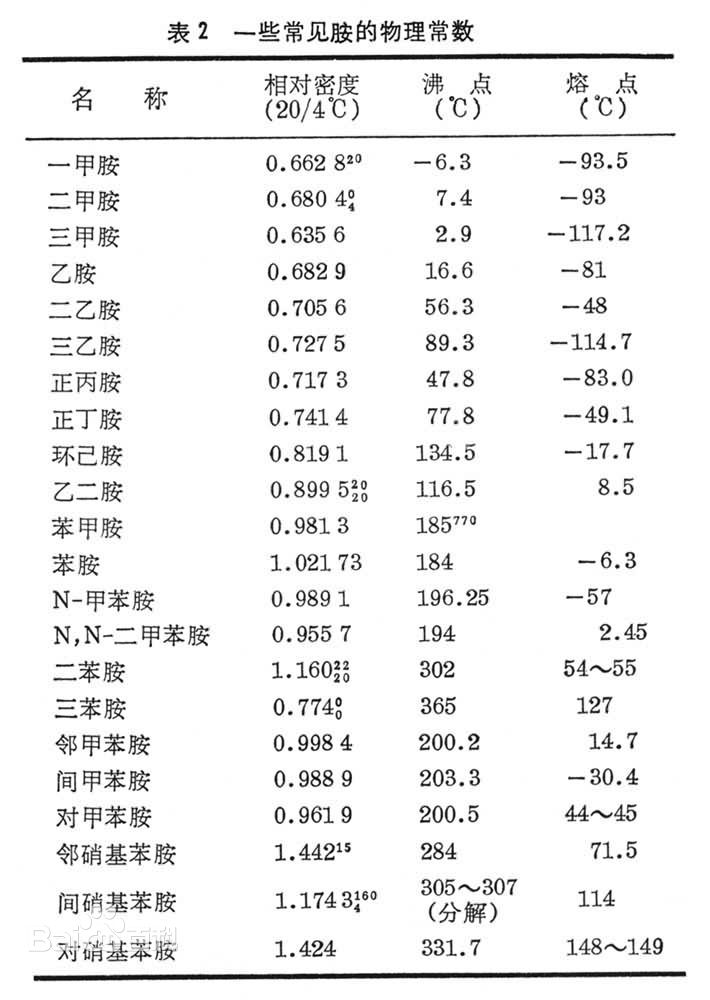
胺具有碱性,在气相条件下氨比任何一种甲胺的碱性都弱得多,但在溶液中其碱性与三甲胺相近,一甲胺和二甲胺的碱性较三甲胺约强10倍。低级的胺是气体或易挥发的液体,气味与氨相似,有的有鱼腥味(鱼的腥味其实就主要来自三甲胺);高级的胺为固体 ;芳香胺多为高沸点的液体或低熔点的固体,具有特殊的气味。胺的沸点比相对分子质量相似的非极性化合物高,比醇或羧酸的沸点低;叔胺的沸点比相对分子质量相近的伯胺和仲胺低。胺是极性化合物。低级胺易溶于水,胺可溶于醇、醚、苯等有机溶剂。
胺与酸作用易成盐。在许多有机反应中,常把胺作为亲核试剂使用。其反应活性通常随碱性的强弱而异,取代基的大小对反应活性的影响较大,位阻较大的胺反应活性降低,例如二异丙基乙基胺已完全不能与卤代烷发生作用。此外,芳香胺的重氮化反应(也就是利用伯胺和亚硝酸在低温条件下反应生成重氮盐的反应)也是重要的有机反应之一(主要是用来制备一些不符合取代基定位规则的化合物如1,3,5-三溴苯和一些特殊的化合物如氟苯等)。
如果想要鉴别各类胺则可以使用Hinsberg鉴定法(也就是利用苯磺酸和胺类反应后看是否生成产物然后再用NaOH溶液溶解)。
物理性质
甲胺、二甲胺、三甲胺和乙胺室温下为气体,其它低级胺为液体;高级胺为固体。
低级胺有氨味,三甲胺有鱼腥味,腐胺(丙二胺)尸胺(丁二胺)有恶臭味。
芳香胺为高沸点的液体或低熔点的固体。
胺与水能形成分子间的氢键。
一级胺和二级胺本身分子间也能形成氢键。
大多数芳胺具有毒性,苯胺可以导致再生障碍。
性贫血,通过吸入,食入或透过皮肤吸收而致中毒,食入0.25 mL就严重中毒。
β– 萘胺与联苯胺是能够引起恶性肿瘤的物质。
光谱性质
IR:胺的N-H伸缩振动吸收:
RNH2:在3400~3490 cm-1处出现2个峰
R2NH:在3300~3500cm-1处 出现1个峰
R3N:在上述区域没有N-H吸收峰
NMR:N-H δ: 0.5~5 ppm
-CH-NH2 δ: 2.2~2.8 ppm
制法
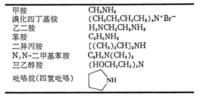 胺的制法
胺的制法胺在自然界中分布很广,其中大多数是由氨基酸脱羧生成的。
例如工业制备胺类的方法多是由氨与醇或卤代烷反应制得,产物为各级胺的混合物,分馏后得到纯品。
由醛、酮在氨存在下催化还原也可得到相应的胺。
工业上也常由硝基化合物、腈、酰胺或含氮杂环化合物催化还原制取胺类化合物。如图所示:
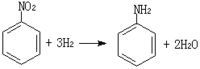 硝基化合物还原制取胺
硝基化合物还原制取胺结构
 胺的结构
胺的结构胺中氮原子的结构,很像氨分子中的氮原子,是以三个sp杂化轨道与氢或烃基相连接,组成一个棱锥体,留下一个sp3杂化轨道由孤电子对占据。如果一个胺有三个不同基团时,应有一对对映体(见对映现象):但由于翻转胺分子中的孤电子对所需要的活化能很低,未能分离出其对映体。
应用
胺的用途很广。最早发展起来的染料工业就是以苯胺为基础的。有些胺是维持生命活动所必需的,但也有些对生命十分有害,不少胺类化合物有致癌作用,尤其是芳香胺,如萘胺、联苯胺等。
参考资料
1.胺新华字典解释·词典网
2.胺类·马可波罗采购百科