亚硝酸(无机化合物)
温馨提示:这篇文章已超过425天没有更新,请注意相关的内容是否还可用!
亚硝酸
无机化合物
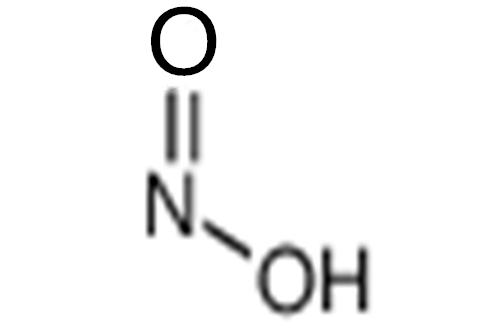
亚硝酸是一种无机化合物,分子式为HNO2,无游离态,只能存在于稀的水溶液中,亮蓝色,为弱酸,电离平衡常数为4.6x10-4。亚硝酸溶液遇微热即分解,酸酐为N2O3。亚硝酸既有氧化性,又有还原性。其氧化性比还原性要强,在酸性介质中更明显。亚硝酸的盐类大多数是无色结晶,易溶于水,有毒。
| 中文名 | 亚硝酸 |
| 化学式 | HNO2 |
| 外观 | 无色液体 |
| CAS号 | 7782-77-6 |
| 摩尔质量 | 47.01g·mol−1 |
| 安全术语 | S:S1/2 S23 S26 S36 S45 |
| 主要危害 | 极毒,致癌性 |
| 气味 | 有刺激性气味 |
理化性质
物理性质
外观与性状:亮蓝色(水溶液)。气味:有刺激性气味。
分子量:47.0134
密度:1.54±0.1g/cm3(Predicted)
化学性质
1、弱酸性
亚硝酸是比醋酸稍强的弱酸,它的电离平衡常数为4.6x10-4。
HNO2↔H++NO2-
亚硝酸HNO2是不稳定的酸,只能存在于稀的水溶液中,临用前以NaNO2的冷稀溶液与H2SO4作用而制得:
NaNO2+H2SO4=NaHSO4+HNO2
亚硝酸溶液遇微热即分解:
2HNO2=NO+NO2+H2O2、
氧化性
亚硝酸及其盐中N原子具有中间氧化态+3,虽然它们既具有氧化性又具有还原性,但以氧化性为主,而且它的氧化能力在稀溶液时比NO3-离子还强,这一点可从它们在酸性溶液中的标准电极电势值看出:
酸性溶液中HNO2的ψθ 值:
HNO2+H++e-↔NO+H2Oψθ=+0.99V
酸性溶液中HNO3的ψθ值:
NO3-+4H++3e-↔NO+2H2Oψθ =+0.95V
在酸性溶液中,HNO2的ψθ值比HNO3的高,所以在稀溶液中NO2-可以将I-氧化成单质I2,而NO3-却不能氧化I-,这是NO2-与NO3-离子的重要区别之一。这个反应可用于鉴定NO2-离子。
2HNO2+2I-+2H+→2NO+I2+2H2O3、
还原性
虽然在酸性溶液中HNO2是个较强的氧化剂,但遇到比它氧化性更强的KMnO4,Cl2等强氧化剂时,它也可以表现出还原性,被氧化为硝酸盐:
5NO2-+2MnO4-+6H+→5NO3-+2Mn2++3H2O
NO2-+Cl2+H2O→NO3-+2H++2Cl-
在碱性溶液中NO2-的还原性是主要的,空气中的氧就能把NO2-氧化成NO3-。
碱性溶液中NO2-和O2的ψθ值如下:
NO3-+H2O+2e-↔NO2-+2OH-ψθ=+0.01V
NO2-+H2O+e-↔NO+2OH-ψθ=-0.46V
O2+2H2O+4e-↔4OH-ψθ=+0.401V
2NO2-+O2→2NO3-4、易生成配位化合物
在NO2-离子中,N原子和O原子上都有孤电子对,它们能分别与许多过渡金属离子生成配位键,形成配位化合物,例如[Co(NO2)4]3-和[Co(NO2)(NH3)5]2+等,它与K+离子生成黄色的K3[Co(NO2)6]沉淀、此方法可用于鉴定K+离子的存在:
3K++[Co(NO2)6]3-→K3[Co(NO2)6]↓(黄色)5、与脂肪和芳香族伯、仲、叔胺作用
脂肪族伯胺与亚硝酸作用,通过重氮化反应,生成极不稳定的脂肪族重氮盐。其重氮盐即使在低温下也会立即自动分解,定量的释放出N2而生成碳正离子。生成的碳正离子可以发生不同反应生成烯烃、醇、卤代烃等混合物。
CH3CH2CH2CH2→〔CH3CH2CH2—N≡N〕+Cl-→N2↑+Cl-+CH3CH2CH2+
能定量的释放出N2,在分析上可根据放出N2的量来定量地测定脂肪伯胺。该反应常用于氨基酸和多肽的定量分析。
芳香伯胺在强酸性溶液中与亚硝酸作用,在较低温度下生成芳香重氮盐。

脂肪和芳香仲胺与亚硝酸作用,生成黄色油状或固体的N-亚硝基化合物。
R2NH+HNO2→R2N—N═O+H2O

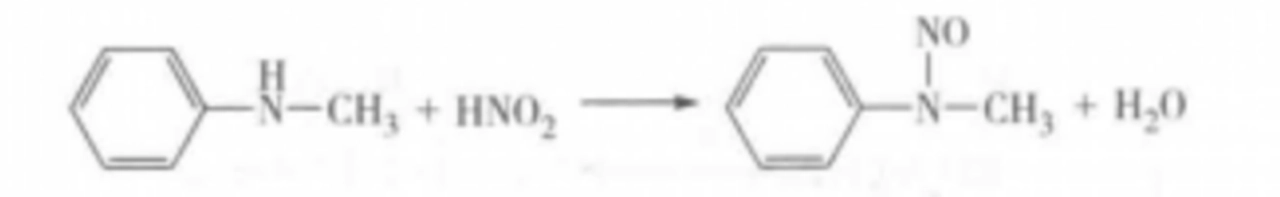
脂肪叔胺与亚硝酸作用,作为弱碱接受质子,生成不稳定易水解的盐。该盐遇碱重新游离析出叔胺。
R3N+HNO2↔R3NH+NO2-
芳香叔胺若对位不含取代基,由于氨基活化芳环,与亚硝酸进行亲电取代,生成对亚硝基胺。
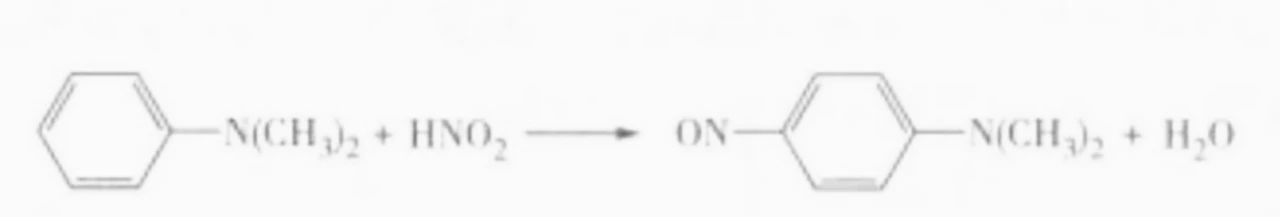
综上所述,利用亚硝酸与脂肪和芳香族伯、仲、叔胺作用生成产物的不同来鉴别胺。6、亚硝酸盐的性质
亚硝酸盐具有很高的热稳定性,可用金属在高温下还原硝酸盐的方法来制备亚硝酸盐:
Pb(粉)+NaNO3→PbO+NaNO2
亚硝酸盐除黄色的AgNO2不溶于水外,一般都易溶于水。
结构
在HNO2分子中,N原子采取sp2杂化,生成两个σ键、一个π键,还有一对孤电子对,NO2-离子为平面三角形结构,N的氧化数为+3。HNO2有两种结构:顺式和反式。一般来讲,反式结构比顺式结构稳定。
制备
通过亚硝酸盐与酸反应制备:
Ba(NO2)2+H2SO4→2HNO2+BaSO4
AgNO2+HCl→HNO2+AgCl↓
用冰水充分冷却下,将Ba(NO2)2(或AgNO2)溶于水中,加入稀硫酸(或稀盐酸)。过滤除去析出的BaSO4(或AgCl)沉淀,亚硝酸留在溶液中。若溶液中有盐存在也无关系时,在低于0℃下,用盐酸酸化亚硝酸钠即可。
用途
1、亚硝酸在工业上用于有机合成,使胺类转变成重氮化合物以制备偶氮染料。2、利用亚硝酸与脂肪和芳香族伯、仲、叔胺作用生成产物的不同来鉴别胺。3、亚硝酸盐是一种食品防腐剂,能防止食品腐败变质,具有显著的杀菌或抑菌效能,特别是在腌肉工业上得到广泛应用。
检验
检测方法
亚硝酸根离子可在酸性介质中,通过和铁(II)反应产生棕色环加以定性检出。
Fe2++NO2-+2H+=Fe3++NO↑+H2O
Fe2++SO42-+NO=[Fe(NO)]SO4
生成棕色的硫酸亚硝酰铁(I)(当酸为醋酸时会反应)
参考资料
1.亚硝酸·ChemicalBook





