硫化铁(无机化合物)
温馨提示:这篇文章已超过424天没有更新,请注意相关的内容是否还可用!

硫化铁
无机化合物
三硫化二铁是一种无机化合物,化学式:Fe2S3,分子量为207.9,是三种铁的硫化物(ironsulfide)之一,为黑色固体,常温下易转变为黄绿色。在空气中容易被氧化,因此自然界中不存在,只能通过实验室化学方法制备。
| 中文名 | 硫化铁 |
| 化学式 | Fe2S3 |
| 外观 | 黄绿色固体 |
| 英文名 | iron sulfide |
| 明书编码 | 2522 |
简介
三硫化二铁简称硫化铁,并不能用三价铁与硫化氢反应制取,因为会发生氧化还原反应。但是干态的三价非离子铁并不能氧化-2价硫元素,而且在强碱性溶液中,Fe3+可以与S2-反应生成三硫化二铁沉淀。
因为Ksp(Fe2S3)=1×10-88,Ksp(Fe(OH)3)=1×10-38
所以在强碱性溶液中Fe3+与S2-相遇会生成Fe2S3,而不是氢氧化铁沉淀。
所以硫化铁其实是存在的,并且相对也较稳定。
 硫化铁
硫化铁制备
硫化铁可由冷冻的Fe3+溶液加入凉的Na2S溶液或(NH4)2S溶液制得:
2Fe3++3S2-→Fe2S3↓
注意,滴加顺序不可颠倒!因为酸性环境中硫化铁会被铁离子氧化:
Fe2S3+4Fe3+→6Fe2++3S
(酸性条件电极电势:S—0.379→Fe2S3,Fe3+—0.77→Fe2+)
(碱性条件电极电势:S—-0.476→S2-,Fe(OH)3—-0.56→Fe(OH)2,Fe2S3—-0.715→FeS)
燃料气体脱硫也有硫化铁生成(见下文)
性质
在20℃以上的水中分解成硫化亚铁和硫:
Fe2S3→2FeS+S
遇酸分解,放出硫化氢气体:
Fe2S3+4H+→2Fe2++2H2S↑+S
 硫化铁
硫化铁来源
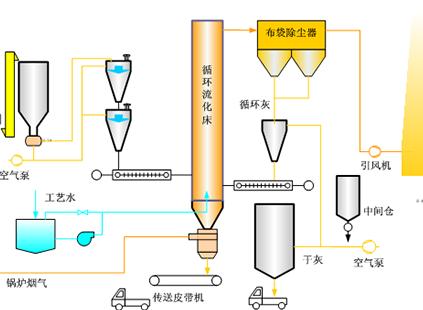
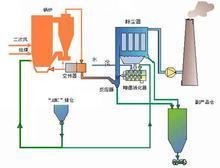
硫化铁一般是氧化铁脱硫剂脱硫后的产物。氧化铁脱硫是最常见的脱硫手段。下边是产生硫化铁的机理:
氧化铁脱硫剂是一种以活性氧化铁(Fe2O3)的水合物为主要脱硫成份的一种脱硫剂。常温下,氧化铁(Fe2O3)分为α-水合物和γ-水合物,两种水合物都具有脱硫作用。非水合物的氧化铁常温下不具有脱硫作用。
氧化铁脱硫剂因其硫容大、价格低、可在常温下空气再生等特点在近几年迅速推广,更主要的原因是可以在无氧条件下脱硫气源中的H2S(活性炭无氧条件下不脱硫),经过近几年的改进,使氧化铁的耐水强度、脱硫精度得到了很大的提高,适应了大多数工业的脱硫工程。
主要应用在高硫化氢的气源环境下、无氧或氧含量低的环境中。如沼气、煤气、水煤气、焦化气的硫化氢脱除。
反应方程式如下:Fe2O3·H2O+3H2S→Fe2S3·H2O+3H2OΔH=-63kJ/mol
Fe2O3·H2O+3H2S→2FeS+S+4H2OΔH=-10kJ/mol
氧化铁脱硫剂与H2S作用并放出热量,根据氧化铁的水合性质不同,产生以上不同的反应形式。
2Fe2S3·H2O+3O2→2Fe2O3·H2O+6SΔH=-126kJ/mol
2FeS·H2O+3O2+2H2O→2Fe2O3·H2O+4SΔH=-179kJ/mol
硫化铁和三硫化二铁在有氧的条件下以及适宜的温度下发生上述还原反应并放出热量。
脱硫原理
在常温下沼气通过脱硫床层,沼气中的硫化氢与活性氧化铁接触,生成三硫化二铁,然后含有硫化物的脱硫剂与空气中的氧接触,当有水存在时,铁的硫化物又转化为氧化铁和单体硫。这种脱硫再过程可循环进行多次,直至氧化铁脱硫剂表面的大部分空隙被硫或其他杂质覆盖而失去活性为止。
脱硫反应为:
Fe2O3·H2O+3H2S→Fe2S3·H2O+3H2OΔH=-63kJ/mol
再生反应为:
2Fe2S3·H2O+3O2→2Fe2O3·H2O+6SΔH=-126kJ/mol
再生后的氧化铁可继续脱除沼气中的H2S。上述两式均为放热反应,但是再生反应比脱硫反应要缓慢。为了使硫化铁充分再生为氧化铁,工程上往往将上述两个过程分开进行。
 硫化铁
硫化铁参考资料
1.硫化铁安全技术说明书·msds查询网